
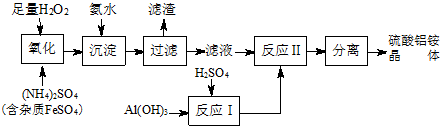
分析 由工艺流程可知,加入过氧化氢将溶液中Fe2+氧化为Fe3+,H2O2+2Fe2++2H+═2 Fe3++2H2O,加入氨水调节溶液PH值,Fe3+使转化为Fe(OH)3,过滤后滤液主要含硫酸铵,氢氧化铝与硫酸混合反应生成硫酸铝溶液,再将硫酸铵和硫酸铝溶液混合反应,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥等最终得到硫酸铝铵晶体.
(1)H2O2与Fe2+在酸性条件下反应生成铁离子和水;
(2)加入氨水调节溶液PH值,Fe3+使转化为Fe(OH)3,一水合氨和铁离子反应生成氢氧化铁沉淀;
(3)过滤后的滤液中可能含有Fe3+,用KSCN溶液检验是否含有Fe3+;
(4)由工艺流程可知,流程中“分离”是从溶液中获得晶体,操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥等,依据原子守恒配平书写化学方程式;
(5)计算晶体中水的质量,根据固体质量差,计算晶体中剩余结晶水的质量,进而计算剩余固体中n[(NH4)Al(SO4)2]:n(H2O),据此书写化学式.
解答 解:(1)由工艺流程可知,加入过氧化氢将溶液中Fe2+氧化为Fe3+,2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(2)加入氨水调节溶液PH值,Fe3+使转化为Fe(OH)3,反应的化学方程式为:Fe2(SO4)3+6NH3•H2O=2Fe(OH)3↓+3(NH4)2SO4,
故答案为:沉淀杂质Fe3+;Fe2(SO4)3+6NH3•H2O=2Fe(OH)3↓+3(NH4)2SO4;
(3)过滤后的滤液中可能含有Fe3+,取少许滤液于试管中,加几滴KSCN[或NH4SCN]溶液,若溶液不变红色,则杂质已除尽,
故答案为:滴入2-3滴KSCN[或NH4SCN]溶液,若溶液不变红色;
(4)由工艺流程可知,流程中“分离”是从溶液中获得晶体,操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥等,依据原子守恒配平得到化学方程式为:2Al2(NH4)2(SO4)4•24H2O$\frac{\underline{\;高温\;}}{\;}$2Al2O3+8SO3↑+4NH3↑+26H2O,
故答案为:蒸发浓缩;冷却结晶;2,8,4,26H2O;
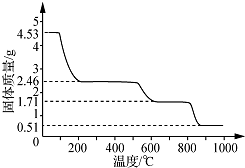
(5)取4.53g硫酸铝铵晶体的物质的量为$\frac{4.53g}{906g/mol}$=0.005mol,4.53g硫酸铝铵晶体中水的质量为0.005mol×24×18g/mol=2.16g,
加热400℃时固体质量减少△m=4.53g-2.46g=2.07g<2.16g,剩余固体中结晶水的物质的量为$\frac{2.16g-2.07g}{18g/mol}$=0.005mol.
剩余固体中n[(NH4)2Al2(SO4)4]:n(H2O)=0.005mol:0.005mol=1:1,故400℃时剩余固体成分的化学式为(NH4)2Al2(SO4)4•H2O.
故答案为:(NH4)2Al2(SO4)4•H2O.
点评 本题考查镁铝及其化合物的性质,对工艺流程理解、常用化学用语、盐类水解、物质的分离提纯与离子检验、化学计算等,综合性较大,题目难度较高,需要学生具备扎实的基础与运用知识分析解决问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | B. | C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2 | ||
| C. | Cu2(OH)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+CO2↑+H2O | D. | FeCl3+3NaOH═Fe(OH)3↓+3NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物油不能使溴的四氯化碳溶液褪色 | |
| B. | 蔗糖水解的最终产物是葡萄糖 | |
| C. | 葡萄糖能发生氧化反应和水解反应 | |
| D. | 蛋白质能发生水解最终生成氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率 | |
| B. | 二氧化氯和三氯化铁都常用于自来水的处理,二者的作用原理是不相同的 | |
| C. | 煤经气化和液化两个物理变化过程,可变为清洁能源 | |
| D. | 乙醇、糖类和蛋白质都是人体必需的营养物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴化银可用于制胶片和有色玻璃 | B. | 过氧化钠可用于漂白织物、羽毛等 | ||
| C. | 碘化银可用于人工降雨 | D. | I2可以用于配制含碘食盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤素离子(X-)只有还原性而无氧化性 | |
| B. | 某元素由化合态变成游离态,该元素一定被氧化 | |
| C. | 失电子难的原子获得电子的能力一定强 | |
| D. | 卤素最高价氧化物的分子式都为X2O7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2017届山西省高三上期中化学试卷(解析版) 题型:选择题
下列说法不正确的是
①光催化还原水制氢比电解水制氢更节能环保、更经济
②氨氮废水(含NH4+及NH3)可用化学氧化法或电化学氧化法处理
③装饰材料释放的甲醛会造成污染
④84消毒液的有效成分是NaClO
⑤大量燃烧化石燃料是造成雾霾天气的一种重要因素
⑥因为NH3.H2O是弱酸,所以不能用氨水与FeCl3溶液反应制取Fe(OH)3
A. 1个 B. 0个 C.2个 D. 4个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com