
 绿矾(FeSO4•7H2O)和胆矾(CuSO4•5H2O)都是重要的化工原料.回答下列问题:
绿矾(FeSO4•7H2O)和胆矾(CuSO4•5H2O)都是重要的化工原料.回答下列问题:分析 (1)铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变成亚铁离子,根据构造原理写出亚铁离子核外电子排布式;
(2)根据SO42-中心原子含有的共价键个数与孤电子对个数之和确定其空间构型和杂化方式;原子个数相等且价电子数相等的微粒为等电子体;
(3)在[Fe(CN)6]4-中,一个 CN-中含有1个?键,每个CN-和Fe间有1个?键;
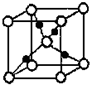
(4)利用均摊法判断实心球与空心球个数之比,然后氧原子的配位数.
解答 解:(1)铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变成亚铁离子,Fe2+在基态时,核外电子排布式为:[Ar]3d6,
故答案为:[Ar]3d6;
(2)SO42-中S原子价层电子对=4+$\frac{1}{2}$(6+2-4×2)=4,且不含孤电子对,所以其立体构型是正四面体,硫原子采取sp3杂化;原子个数相等且价电子数相等的微粒为等电子体,与SO42-互为等电子体的微粒为:CCl4、PO43-、SiO44-,
故答案为:正四面体;sp3;CCl4、PO43-、SiO44-;
(3)在[Fe(CN)6]4-中,一个 CN-中含有1个?键,每个CN-和Fe间有1个?键,所以1mol[Fe(CN)6]4-中含有12mol?键,
故答案为:12 mol;
(4)根据晶胞的结构图结合均摊法可知,晶胞中空心球与实心球个数比为:(8×$\frac{1}{8}$+1):4=1:2,所以空心球为氧原子,实心球为铜原子,距离氧原子最近的铜原子有四个,所以氧的配位数是4,
故答案为:4.
点评 本题考查了配合物的成键判断、核外电子排布、离子空间构型的判断等知识,题目难度中等,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用能力,注意掌握常见元素核外电子排布式的书写方法,明确均摊法在晶胞计算中的应用.


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:多选题

| A. | 气体A一定没有CO2,气体B一定是NH3 | |
| B. | 有色沉淀一定是混合物 | |
| C. | Na+可能存在于该溶液中 | |
| D. | 白色沉淀中一定没有Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图为常温下,向25ml某浓度的NaOH溶液中逐滴加入0.2mol•L-1CH3COOH溶液的过程中溶液pH的变化曲线,下列说法不正确的是( )
如图为常温下,向25ml某浓度的NaOH溶液中逐滴加入0.2mol•L-1CH3COOH溶液的过程中溶液pH的变化曲线,下列说法不正确的是( )| A. | NaOH溶液起始浓度为0.1mol•L-1 | |
| B. | a>12.5 | |
| C. | B点溶液中c(Na+)一定等于c(CH3COO-) | |
| D. | D点溶液中:c(Na+)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,17g甲基(-14CH3)所含的中子数为9NA | |
| B. | 42.0 g乙烯和丙烯的混合气体中含有的碳原子数为3NA | |
| C. | 标准状况下,11.2L苯中含有的碳碳双键数为1.5NA | |
| D. | 5.6g铁与0.1mol氯气在点燃条件下充分反应,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 洗涤沉淀的操作是将沉淀置于滤纸上(已放置在漏斗中),边用玻璃棒搅拌边加蒸馏水冲洗 | |
| B. | 酸碱中和滴定常用的指示剂有酚酞、甲基橙和石蕊试液 | |
| C. | 除去Fe(OH)3胶体中的NaCl时,可将其装在用半透膜做的袋子里,放在流动的蒸馏水中,该分离方法称为渗析 | |
| D. | 将适量植物油、酒精和NaOH溶液混合,并不断搅拌、加热,直到混合物变稠,即可以制得肥皂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )可由下列路线合成:
)可由下列路线合成: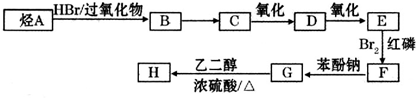
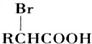
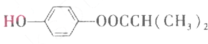 .
.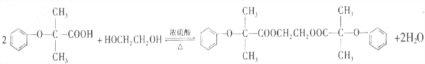 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “地沟油”危害健康,是因为脂肪酸油脂中的碳碳双键被破坏,不利健康 | |
| B. | 浸泡过高锰酸钾溶液的硅藻土可用作水果保鲜制是因为高锰酸钾溶液可吸收水果释放的乙烯 | |
| C. | 废旧电池必须回收利用,是因为电池中的重金属等会严重污染土壤和水体 | |
| D. | 食品包装袋、食物保鲜膜通常用聚乙烯树脂,是因为聚乙烯树脂是无毒的高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
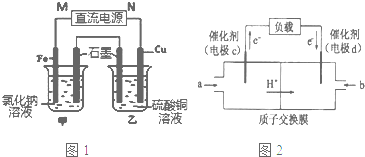
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com