
设NA表示阿伏加德罗常数,下列说法正确的是( )
A.常温常压下,23 g NO2和N2O4的混合气体一定含有NA个氧原子
B.1 L 0.1 mol/L NaHSO4溶液中含有0.1 NA个HSO4-
C.将0.1 mol FeCl3溶于沸水制成胶体,其中含有的胶体粒子数目为0.1 NA
D.0.1molNa2O2固体与足量的H2O充分反应,转移0.2NA个电子
A
【解析】
试题分析:A. 若23 g 全是NO2,则n(NO2)=23g÷46g/mol=0.5mol,n(O)=1mol. 若23 g 全是N2O4,则n(N2O4) =23g÷92g/mol=0.25mol,n(O)=1mol.所以23 g NO2和N2O4的混合气体一定含有NA个氧原子。正确。B.在水溶液中发生电离:NaHSO4=Na++H++SO42-。因此溶液中无HSO4-。错误。C.将0.1 mol FeCl3溶于沸水发生水解制成胶体时,发生水解反应的离子只是其中的很少一部分离子。故错误。D.在 2Na2O2 + 2H2O=4NaOH+O2↑反应中,每摩尔Na2O2的充分反应,转移NA个电子。所以0.1molNa2O2固体充分反应,转移0.1NA个电子.错误。
考点:考查有关阿伏加德罗常数的计算的知识。


科目:高中化学 来源:2016届陕西省安康市高一上学期期末质量检测化学试卷(解析版) 题型:选择题
下列方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是 ( )
A.取a克混合物充分加热,残留固体b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量Ba(OH)2溶液充分反应,最终得b克BaCO3
D.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省沈阳市高一上教学质量监测化学试卷(解析版) 题型:选择题
下列叙述中正确的是
A.稀硝酸、稀硫酸均能将木炭氧化成二氧化碳
B.Na2O2与水反应,红热的Fe与水蒸气反应均能生成气体
C.C、S分别在氧气中燃烧均可生成两种相应氧化物
D.NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高一上学期12月月考化学试卷(解析版) 题型:选择题
将一定质量的镁和铝混合物投入200 mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入的NaOH溶液体积的变化关系如图所示。则下列说法不正确的是( )
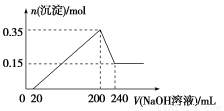
A.镁和铝的总质量为9 g
B.合金与稀硫酸反应生成的氢气体积为10.08 L
C.稀硫酸的物质的量浓度为2.5 mol/L
D.氢氧化钠溶液的物质的量浓度为5 mol/L
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高一上学期12月月考化学试卷(解析版) 题型:选择题
用下列方法来制备溶胶:①0.5 mol/L BaCl2溶液和等体积2mol/L硫酸相混合并振荡;
②把5、6滴饱和三氯化铁溶液滴加入20mL沸水中,边加边振荡;③将盐酸逐滴加入到饱和Na2SiO3溶液中,用力振荡。可行的是( )
A.①② B.①③ C.②③ D.①②③
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高一上学期12月月考化学试卷(解析版) 题型:选择题
下面叙述中,正确的是( )
A.硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位
B.水泥是重要的硅酸盐产品,以纯碱、石灰石、二氧化硅为原料
C.硅的化学性质不活泼,在自然界中可以以游离态存在
D.硅是一种亲氧元素,在自然界中它总是与氧相互化合
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省大连市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列关于Na2CO3和NaHCO3的性质比较中,不正确的是
A.热稳定性: Na2CO3 > NaHCO3
B.常温时在水中的溶解度:Na2CO3 > NaHCO3
C.与稀盐酸反应的剧烈程度:Na2CO3 > NaHCO3
D.等质量的固体与足量的盐酸反应放出CO2的质量:NaHCO3 > Na2CO3
查看答案和解析>>
科目:高中化学 来源:2016届福建省龙岩市高一第一学期教学质量检测化学试卷(解析版) 题型:填空题
铁是人类较早使用的金属之一。运用所学知识,回答下列问题。
(1)鉴别Fe(OH)3胶体和FeCl3溶液的方法是 。
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式: 。
(3)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子是 ;②溶液组成的测定:取50.0mL待测溶液,加入足量的AgNO3溶液,得21.525g白色沉淀。则溶液中c(Cl-)= mol·L-1。
③验证该溶液中含有Fe2+,正确的实验方法是 。
A.观察溶液是否呈浅绿色
B.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.取适量溶液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(4)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:

①滤渣C的化学式为 。
②加过量D发生反应的离子方程式为 。
③通入F发生反应的化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com