
肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物,则NH3分子的空间构型是________;N2H4分子中氮原子轨道的杂化类型是__________。
科目:高中化学 来源: 题型:
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是( )
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B.元素X不能与元素Y形成化合物X2Y2
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
D.元素W、R的最高价氧化物的水化物都是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
1919年,Langmuir提出等电子原理:原子数相同、电子总数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近。
(1)根据上述原理,仅由第2周期元素组成的共价分子中,互为等电子体的是________和________;________和
________________________。
(2)此后,等电子原理又有所发展。例如,由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与NO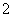 互为等电子体的分子有________、________。
互为等电子体的分子有________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
判断含氧酸酸性强弱的一条经验规律是含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。如下表所示:
含氧酸酸性强弱与非羟基氧原子数的关系
| 次氯酸 | 磷酸 | 高氯酸 | |
| 含氧酸 | Cl-OH |
|
|
| 非羟基氧原子数 | 0 | 1 | 3 |
| 酸性 | 弱酸 | 中强酸 | 最强酸 |
(1)亚磷酸H3PO3和亚砷酸H3AsO3分子式相似,但它们的酸性差别很大,H3PO3是中强酸,H3AsO3既有弱酸性又有弱碱性。由此可推出它们的结构简式分别为①________________,②________________。
(2)H3PO3和H3AsO3与过量的NaOH溶液反应的化学方程式分别是:
①________________________________________________________________________,
②________________________________________________________________________。
(3)在H3PO3和H3AsO3中分别加入浓盐酸,分析反应情况:________________________________________________________________________,
写出化学方程式:_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。元素Z的原子最外层电子数是其内层的3倍。
则①与YZ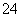 互为等电子体的分子的化学式:________(任写一种)。
互为等电子体的分子的化学式:________(任写一种)。
②X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1 mol该配合物中含有σ键的数目为________。
③Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是______________________________________________,
反应的化学方程式为_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
镁/H2O2酸性燃料电池采用海水作电解质(加入一定量的酸),下列说法正确的是 ( )。
A.电池总反应为Mg+H2O2===Mg(OH)2
B.正极发生的电极反应为H2O2+2H++2e-===2H2O
C.工作时,正极周围海水的pH减小
D.电池工作时,溶液中的H+向负极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
.A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如下所示。A是短周期中原子半径最小的元素,A、B、C三种元素的原子序数之和等于D元素的原子序数,E是短周期中最活泼的金属元素。下列说法错误的是( )
| B | C |
| D |
A.简单离子的半径大小关系:B>C>E
B.C元素的气态氢化物比D元素的气态氢化物稳定性弱
C.由A、B两种元素组成的离子化合物BA5中,阴、阳离子个数比为1∶1
D.由C、D、E三种元素组成的某种化合物,其水溶液能与盐酸反应产生气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com