
| A. | 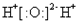 | B. | Cl:Cl | C. | 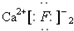 | D. |  |
分析 A、为共价化合物,氧原子最外层8个电子,分子中存在两个氧氢键;
B、氯气中存在1对氯氯共用电子对,氯原子最外层达到8电子稳定结构;
C、相同离子不能合并;
D、氯化钠由钠离子和氯离子构成.
解答 解:A、水中存在两个氧氢键,氧原子最外层达到8电子稳定结构,水的电子式为 ,故A错误;
,故A错误;
B、氯气中存在1对氯氯共用电子对,氯原子最外层达到8电子稳定结构,故Cl2的电子式为 ,故B错误;
,故B错误;
C、氟化钙为离子化合物,钙离子直接用离子符号Ca2+表示,氟离子需要标出其最外层电子及所带电荷,两个氟离子需要先在钙离子的两边,氟化钙的电子式为: ,故C错误;
,故C错误;
D、氯化钠是离子化合物,是钠离子和氯离子通过静电作用形成的,其电子式为 ,故D正确.
,故D正确.
故选D.
点评 本题考查了电子式的书写,应注意的是写电子式之前先区分是共价化合物还是离子化合物.


科目:高中化学 来源: 题型:选择题
| A. | 同种核素 | B. | 同位素 | C. | 同素异形体 | D. | 同种分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na2CO3溶液中逐滴加入HCl,直到不再生成CO2气体为止,在此过程中,溶液中HCO3-的浓度变化是先变大后变小(溶液体积变化均忽略不计) | |
| B. | 向NaHCO3溶液中加入Ba(OH)2固体,CO32-的浓度变化是先变大后变小(溶液体积变化均忽略不计) | |
| C. | 有含0.2molNa2CO3和含0.3molHCl的两种溶液:①将Na2CO3溶液逐滴滴入HCl溶液中;②将HCl溶液逐滴滴入Na2CO3溶液中.①②两种操作生成CO2的体积之比为3:2 | |
| D. | 将等质量的Na2O和Na2O2样品分别放入等量的水中,所得溶液的质量分数分别为a%和b%,则a、b的关系是a=b |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子半径:X>Y | |
| B. | 失电子能力:X<Y | |
| C. | 对应简单离子的氧化性:X>Y | |
| D. | X元素的单质跟酸反应置换出氢气比Y容易 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
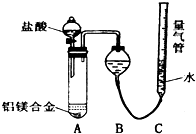 铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列三种不同实验方案进行探究.填写下列空白.
铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列三种不同实验方案进行探究.填写下列空白.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH- | |
| B. | 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+ | |
| C. | 用惰性电极分别电解熔融氯化钠和饱和食盐水时,阳极的电极反应式均为:2Cl--2e-=Cl2↑ | |
| D. | 钢铁发生吸氧腐蚀时的正极反应式:Fe-2e-=Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维在信息领域应用越来越广泛,其主要成分是硅单质 | |
| B. | “地沟油”禁止食用,但可以用来制肥皂 | |
| C. | 明矾常用于水体杀菌消毒 | |
| D. | 中秋将至,为防止月饼等富脂食品氧化变质,常在包装袋中放入生石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | RCOOH与R′OH发生酯化反应时生成R′OOCR | |
| B. | 能与NaOH溶液反应,分子式为C2H4O2的有机物一定是羧酸 | |
| C. | 甲酸乙酯、乙酸甲酯、丙酸互为同分异构体 | |
| D. | 甲醛与乙酸乙酯的最简式相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com