
类推是学习和研究的重要思维方法.下列类推结论正确的是()
化学事实 类推结论
A Al在O2中燃烧生成Al2O3 Fe在O2中燃烧也生成Fe2O3
B pH=3的盐酸稀释1000倍后pH=6 pH=6的盐酸稀释1000倍后pH=9
C 用电解熔融MgCl2的方法冶炼金属镁 用电解熔融NaCl的方法制取金属钠
D 将SO2通入BaCl2溶液中无沉淀生成 将SO2通入Ba(NO3)2溶液中也无沉淀生成
A. A B. B C. C D. D
考点: 常见金属元素的单质及其化合物的综合应用;pH的简单计算;二氧化硫的化学性质;金属冶炼的一般原理.
专题: 类比迁移思想.
分析: A、铝在氧气中燃烧生成最高价氧化物,而燃烧生成是四氧化三铁;
B、酸无论如何稀释,不会改变性质,仍然是酸;
C、工业上制得活泼金属,都是电解熔融的盐而在阴极得到金属;
D、SO2通入BaCl2溶液中无沉淀生成,是弱酸不能制强酸,而SO2通入Ba(NO3)2溶液中发生了氧化还原反应,生成了白色的硫酸钡沉淀.
解答: 解:A、铁燃烧生成是四氧化三铁,方程为:3Fe+2O2 Fe3O4,所以类推错误,故A不选;
Fe3O4,所以类推错误,故A不选;
B、pH=6的盐酸稀释1000倍后pH=9,溶液的pH无限接近7,不可显碱性,故B不选;
C、工业上制得活泼金属,都是电解熔融的盐而在阴极得到金属,以制钠为例,方程式为2NaCl(熔融) 2Na+Cl2↑,故选C;
2Na+Cl2↑,故选C;
D、SO2通入Ba(NO3)2溶液中发生了氧化还原反应,生成了白色的硫酸钡沉淀,离子方程式为4H2O+3SO2+3Ba2++NO3﹣=3BaSO4↓+NO↑+8H+,故D不选;
故选C
点评: 本题考查有关元素及其化合物性质的类比,要解决此类问题必须在熟练掌握元素及化合物性质的基础上,才能得心应手!


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
某有机物的结构为HO﹣CH2﹣CH=CHCH2﹣COOH,该有机物不可能发生的化学反应是( )
|
| A. | 水解反应 | B. | 酯化反应 | C. | 加成反应 | D. | 氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有关碰撞理论,下列说法中正确的是( )
|
| A. | 具有足够能量的分子(活化分子)相互碰撞就一定能发生化学反应 |
|
| B. | 增大反应物浓度,可增大活化分子的百分数,从而使有效碰撞次数增大 |
|
| C. | 升温能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 |
|
| D. | 催化剂不影响反应活化能,从而只影响反应速率不影响化学平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家一直致力于研究常温、常压下“人工固氮”的新方法.曾有报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3和另一种常见气体.进一步研究NH3生成量与温度的关系(其它条件均相同),部分实验数据见下表:
| T/K | 303 | 313 | 323 |
| 平衡时NH3的生成量/(10﹣6mol) | 4.8 | 5.9 | 6.0 |
回答下列问题:
(1)写出该反应的化学方程式
(2)该反应的焓变△H 0(填“>”、“<”或“=”)
(3)请在答题纸的坐标图中画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注.
(4)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢.请提出可提高其反应速率且增大NH3生成量的建议: .
(5)已知:
N2(g)+3H2(g)═2NH3(g)△H=﹣92.4kJ/mol
H2(g)+Cl2(g)═2HCl(g)△H=﹣184.6kJ/mol
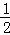 N2(g)+2H2(g)+
N2(g)+2H2(g)+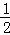 Cl2(g)═NH4Cl(s)△H=﹣313.6kJ/mol
Cl2(g)═NH4Cl(s)△H=﹣313.6kJ/mol
计算NH3(g)+HCl(g)═NH4Cl(s)的反应焓变:△H= .
查看答案和解析>>
科目:高中化学 来源: 题型:
同温同压下,在3支体积不同的试管中分别充满等体积混合的2种气体,它们是:①NO和NO2,②NO2和O2,③NH3和N2.现将3支试管均倒置于水槽中,充分反应后,试管中溶质的物质的量浓度分别为c1、c2、c3(假设溶质全在试管中),则下列关系正确的是()
A. c1>c2>c3 B. c1>c3>c2 C. c1=c3>c2 D. c1=c2>c3
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,在下列给定条件的溶液中,一定能大量共存的离子组是()
A. 能使pH试纸呈红色的溶液:Na+、NH4+、I﹣、NO3﹣
B. 加入铝粉生成H2的溶液:K+、Mg2+、SO42﹣、HCO3﹣
C. c(Fe3+)=0.1mol•L﹣1的溶液:H+、Al3+、I﹣、SCN﹣
D. 常温下pH=12的溶液:Na+、K+、SiO32﹣、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
1996年诺贝尔化学奖授予斯莫利等三位化学家,以表彰他们发现富勒烯(C60)开辟了化学研究的新领域.后来,人们又发现了一种含碳量极高的链式炔烃──棒碳,它是分子中含300~500个碳原子的新物质,其分子中只含有交替连接的单键和叁键.对于C60与棒碳,下列说法正确的是( )
|
| A. | C60与棒碳中所有的化学键都是非极性共价键 |
|
| B. | 棒碳不能使溴水褪色 |
|
| C. | C60在一定条件下可能与CuO发生置换反应 |
|
| D. | 棒碳与乙炔互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
黄曲霉素是污染粮食的真菌霉素,其结构如图,人类的特殊基因在黄曲霉素的作用下会发生突变,有转变成肝癌的可能性.下列的说法正确的是( )

|
| A. | 黄曲霉素能发生取代反应和消去反应 |
|
| B. | 1mol黄曲霉素能与6mol氢气发生加成反应 |
|
| C. | 1mol黄曲霉素能与含1mol NaOH的水溶液完全反应 |
|
| D. | 黄曲霉素能与溴水反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com