
| A. | 将纯水加热到90℃ | B. | 向水中加少量Na2CO3溶液 | ||
| C. | 向水中加少量NaOH溶液 | D. | 向水中加少量FeCl3溶液 |
分析 水的电离是吸热反应,升高温度促进水电离,水电离生成氢离子和氢氧根离子,所以酸或碱、强酸酸式盐都抑制水电离,含有弱离子的盐促进水电离,据此分析解答.
解答 解:水的电离是吸热反应,升高温度促进水电离,水电离生成氢离子和氢氧根离子,所以酸或碱、强酸酸式盐都抑制水电离,含有弱离子的盐促进水电离,
A.升高温度促进水电离,溶液中氢离子浓度增大,溶液的pH减小,故A错误;
B.碳酸钠是强碱弱酸盐,碳酸根离子水解促进水电离,生成氢氧根离子而导致溶液呈碱性,故B正确;
C.NaOH电离生成氢氧根离子而抑制水电离,故C错误;
D.氯化铁是强酸弱碱盐,铁离子水解而促进水电离,生成氢离子而导致溶液呈酸性,故D错误;
故选B.
点评 本题以水的电离为载体考查盐类水解、水电离影响因素,侧重考查分析能力,明确水电离特点及盐类水解特点即可解答,注意升高温度促进水电离但溶液不能变为酸性或碱性,为易错点.


科目:高中化学 来源:2017届黑龙江省哈尔滨市高三上学期期中考试化学试卷(解析版) 题型:简答题
能源的开发利用与人类社会的可持续性发展息息相关。
I.已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H1=akJ·mol-1
CO(g)+1/2O2(g)=CO2(g)△H2=bkJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s)△H3=ckJ·mol-1
则C的燃烧热________kJ·mol-1
Ⅱ.(1)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是(填序号)。
A.C(s)+CO2(g)=2CO(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)
C.2H2O(l)=2H2(g)+O2(g)
D.2CO(g)+O2(g)=2CO2(g)
若以熔融的K2C03与C02为反应的环境,依据所选反应设计成一个原电池,请写出该原电池的负极反应:。
(2)某实验小组模拟工业合成氨反应N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ·mol-1,开始他们将N2和H2混合气体20mol(体积比1:1)充入5L合成塔中。反应前压强为P。,反应过程中压强用P表示,反应过程中P/P。与时间t的关系如下图所示。请回答下列问题:
2NH3(g)△H=-92.4kJ·mol-1,开始他们将N2和H2混合气体20mol(体积比1:1)充入5L合成塔中。反应前压强为P。,反应过程中压强用P表示,反应过程中P/P。与时间t的关系如下图所示。请回答下列问题:

①反应达平衡的标志是(填字母代号)。
A.压强保持不变
B.气体密度保持不变
C.NH3的生成速率是N2的生成速率的2倍
②2min时,以C(N2)变化表示的平均反应速率为。
③若提高N2的转化率可采取的措施有。
A.向体系中按体积比1:1再充入N2和H2
B.分离出NH3
C.升高温度
D.充入He气使压强增大E.加入一定量的N2
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | ①和②、③与④分别互为同分异构体 | |
| B. | ①、③互为同系物 | |
| C. | ①、②、③、④均能与氢氧化钠溶液反应 | |
| D. | 等物质的量的②、④分别在足量氧气中完全燃烧,前者消耗氧气比后者少 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | KClO3在反应中是氧化剂 | |
| B. | 1mol KClO3参加反应,在标准状况下能得到22.4L气体 | |
| C. | 在反应中H2C2O4既不是氧化剂也不是还原剂 | |
| D. | 1mol KClO3参加反应有1mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
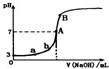
| A. | 由图可知HA是一种弱酸,且Ka=1.0×10-5 | |
| B. | 水电离出的氢离子浓度:a<b | |
| C. | 当NaOH溶液的体积为10.00mL时,有:c(A-)+c(OH-)=c(H+)+c(HA) | |
| D. | B点溶液中的离子浓度关系为:c(Na+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Cl-、Na+、K+ | B. | K+、Na+、NO3-、HCO3- | ||
| C. | Na+、SO32-、Cl-、NO3- | D. | Fe3+、Na+、AlO2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;B的水溶液不呈中性的原因NH4++H2O?NH3.H2O+H+(用离子方程式表示)
;B的水溶液不呈中性的原因NH4++H2O?NH3.H2O+H+(用离子方程式表示)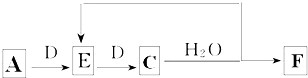
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 7种 | C. | 6种 | D. | 5种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com