
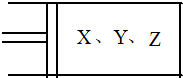 如图所示,将6mol X和3mol Y混合气体置于体积可变的等压容器中,在一定温度下发生如下反应:2X(g)+Y(g)?2Z(g).反应达到平衡状态A时,测得气体总物质的量为6.6mol.若X、Y、Z的起始物质的量分别用a.b.c表示,回答下列问题:
如图所示,将6mol X和3mol Y混合气体置于体积可变的等压容器中,在一定温度下发生如下反应:2X(g)+Y(g)?2Z(g).反应达到平衡状态A时,测得气体总物质的量为6.6mol.若X、Y、Z的起始物质的量分别用a.b.c表示,回答下列问题:| 2.4 |
| 3 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| 实验操作 | 实验目的 | |
| A | 苯和溴水混合后加入铁粉 | 制溴苯 |
| B | 某有机物与溴的四氯化碳溶液混合 | 确认该有机物含碳碳双键 |
| C | 乙醇与重铬酸钾(K2Cr2O7)酸性溶液混合 | 乙醇具有还原性 |
| D | 将溴乙烷与氢氧化钠水溶液共热一段时间,冷却,向其中滴加硝酸银溶液 | 检验溴乙烷中的溴原子 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硅可用于制造光导纤维 |
| B、小苏打可用于面粉发酵 |
| C、酒精可用作汽车燃料 |
| D、明矾可用于自来水杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
| 催化剂 |
| △ |
| 催化剂 |
| △ |
| 催化剂 |
| △ |
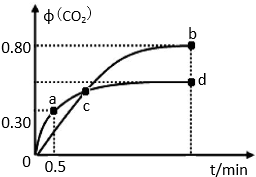
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| c(H+) | 6.3×10-9 | 6.3×10-8 | 6.3×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com