
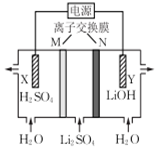
| A. | X电极连接电源负极 | |
| B. | N为阳离子交换膜 | |
| C. | Y电极反应式为O2+2H2O+4e-═4OH- | |
| D. | 制备2.4 g LiOH产生的H2在标准状况下为2.24 L |
分析 该电解池实质是电解水,根据图知,Y极导出的LiOH,则Y极是水电离出的氢离子放电生成氢气,则Y为电解池的阴极,阴极电极反应式为2H2O+2e-=2OH-+H2↑;X极导出的是硫酸,则X极应为水电离出的氢氧根放电,则X极为阳极,阳极反应式为2H2O-4e-=4H++O2↑,据此分析解答.
解答 解:A.根据以上分析,X极导出的是硫酸,则X极应为水电离出的氢氧根放电,则X极为阳极,应与电源正极相连,故A错误;
B.由图可知LiOH从最右侧导出,则Li+需通过N进入最右侧,故N为阳离子交换膜,故B正确;
C.Y极导出的LiOH,则Y极是水电离出的氢离子放电生成氢气,阴极电极反应式为2H2O+2e-=2OH-+H2↑,故C错误;
D.制备2.4 g LiOH,n(OH-)=$\frac{2.4g}{24g/mol}$=0.1mol,阴极电极反应式为2H2O+2e-=2OH-+H2↑,则n(H2)=0.05mol,为0.05mol×22.4L/mol=1.12L,故D错误;
故选B.
点评 本题考查电解原理,为高频考点,明确各个电极上发生的反应、各个区域电解质溶液成分是解本题的关键,会正确书写电极反应式,题目难度不大.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案科目:高中化学 来源: 题型:解答题
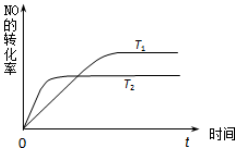 近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物.回答下列问题:
近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物.回答下列问题:| 容器代号 | NO | N2 | O2 |
| A | 2 | 0 | 0 |
| B | 0 | 1 | 1 |
| C | 0.4 | 0.6 | 0.8 |
| D | 1 | 0.5 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 西维因分子式为C12H10NO2 | |
| B. | 西维因分子中至少有21个原子共平面 | |
| C. | 1mol西维因最多能与6mol氢气发生加成反应 | |
| D. | 取一段时间后的混合液,先用盐酸酸化,再滴加FeCl3溶液,可检验西维因是否发生水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 重大节日期间燃放的焰火的颜色是某些金属元素焰色反应所呈现出来的色彩 | |
| B. | 小苏打是制作馒头和面包等糕点的膨松剂,也是治疗胃酸过多的一种药剂 | |
| C. | 为防止月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶 | |
| D. | 大力实施矿物燃料的脱硫脱硝技术,可以减少SO2、NO2的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去,2min后,试管里出现凝胶 | 非金属性:Cl>Si |
| B | 向滴有甲基橙的AgNO3溶液中滴加KCl溶液,溶液由红色变为黄色 | KCl溶液具有碱性 |
| C | 在CuSO4溶液中滴加KI溶液,再加入苯,振荡,有白色沉淀生成,苯层呈紫色 | 白色沉淀可能为CuI |
| D | 某溶液滴加盐酸酸化的BaCl2溶液,生成白色沉淀 | 该溶液中可能不含SO42- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2具有还原性,可用于漂白纸浆 | |
| B. | 碳酸氢钠能与碱反应,可用作食品的膨松剂 | |
| C. | 四氯化碳密度比水大,可用于萃取溴水中的Br2 | |
| D. | MgO、Al2O3的熔点都很高,都可用作耐火材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
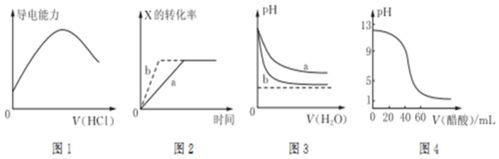
| A. | 图1表示向氨水中通入HC1气体,溶液的导电能力变化 | |
| B. | 图2所示反应:X(g)+2Y(g)?3Z(g),b曲线表示的一定是增大压强 | |
| C. | 图3可表示pH相同的NaOH溶液与氨水稀释过程的pH变化,其中曲线a对应氨水 | |
| D. | 图4可表示用0.100 0 mol/L,醋酸滴定40.00 mL 0.100 0 mol/L NaOH溶液得到的滴定曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3的醋酸与pH=11的氢氧化钾 | B. | 0.1mol/L的盐酸与0.1mol/L的氨水 | ||
| C. | 0.001mol/L的盐酸与pH=11的氨水 | D. | pH=3的盐酸与0.001mol/L的氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
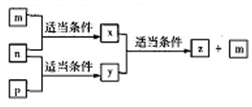 A、B、C、D四种原子序数依次增大的分别位于三个不同短周期的主族元素,m、p、n分别是元素A、B、C的单质,x、y、z是由A、B、C组成的二元化合物,其中y、z是气体且x是用于配制饮料,它们之间有如图转化关系,D的单质可与热水发生置换反应,下列说法正确的是( )
A、B、C、D四种原子序数依次增大的分别位于三个不同短周期的主族元素,m、p、n分别是元素A、B、C的单质,x、y、z是由A、B、C组成的二元化合物,其中y、z是气体且x是用于配制饮料,它们之间有如图转化关系,D的单质可与热水发生置换反应,下列说法正确的是( )| A. | D的单质起火燃烧时可用x作灭火剂 | |
| B. | 元素的非金属性:C>A>B>D | |
| C. | B、C、D与A形成的简单化合物的熔点:C>D>B | |
| D. | 原子半径:D>B>C>A |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com