
【题目】向10.0mL0.10mol/L氨水中滴入0.10mol/L的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出),下列有关叙述正确的是

A. M~N间一定存在:c(Cl-)>c(NH4+)>c(OH-)>c(H+) B. M点对应的盐酸体积为10.0mL
C. M、N两点所示溶液中水的电离程度相同 D. P点处的溶液中存在2c(NH4+)+2c(NH3·H2O)=c(Cl-)
【答案】D
【解析】盐酸滴入氨水的过程中始终存在电荷守恒:c(NH4+)+c(H+)=c(OH-)+c(Cl-)。A项, 违背电荷守恒,错误;B项,若加入10.0mL盐酸,氨水与盐酸恰好完全反应获得NH4Cl溶液,NH4Cl溶液中由于NH4+的水解溶液呈酸性,M点pH=7,则M点对应盐酸体积小于10.0mL,错误;C项,N点为氨水,NH3·H2O电离出的OH-对水的电离起抑制作用,从N点到M点,随着盐酸的加入生成可水解的NH4Cl,水的电离程度逐渐增大,M点水的电离程度大于N点水的电离程度,错误;D项,P点加入20.0mL盐酸时,溶液中的物料守恒为2c(NH4+)+2c(NH3·H2O)=c(Cl-),正确;答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】向相同容积的甲乙两容器中都分别充入1molSO2和0.5molO2,若甲容器保持温度容积不变,乙容器保持温度压强不变,分别达到平衡,下列说法正确的是
A. 平衡时,容器内的压强:甲>乙 B. 反应达到平衡时所需时间:甲<乙
C. 平衡时,氧气的浓度:甲<乙 D. 平衡时,容器内SO3的体积百分数:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:
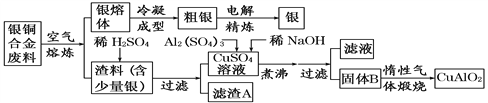
[注:Al(OH)3和Cu(OH)2 开始分解的温度分别为450℃和80℃]
(1)滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学反应方程式为_________________。
(2)固体混合物B的组成为__________、__________。
(3)完成煅烧过程中一个反应的化学方程式:__________________________________↑。
(4)若银铜合金中铜的质量分数为64.0%,理论上5.0kg废料中的铜可完全转化为CuAlO2,至少需要1.0 mol·L-1的Al2(SO4)3溶液________L。
(5)CuSO4溶液也可用于制备胆矾,其基本操作是___________、__________、过滤、洗涤和干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置进行木炭粉和浓硫酸的反应及其全部产物的检验。
已知:紫红色的酸性高锰酸钾溶液能与二氧化硫发生氧化还原反应,向酸性高锰酸钾溶液通入足量的二氧化硫气体,溶液的紫红色会完全褪去。
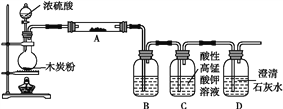
(1)组装好上述装置后,首先要进行的操作是________________。
(2)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式:_________________。
(3)装置A中试剂的化学式为______,装置B的作用是____________________________。
(4)实验时,可以说明生成二氧化碳的实验现象是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. HCl的酸性>H2CO3的酸性,所以非金属性Cl>C B. 由非金属元素组成的化合物可能是离子化合物
C. 熔融状态能导电的物质一定是离子化合物 D. 由分子组成的物质中一定存在共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中正确的是
A. 过滤操作时,用玻璃棒搅拌漏斗内的液体,以加速过滤
B. 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
C. 萃取操作时,可以选用CCl4作为萃取剂从碘水中萃取碘
D. 分液操作时,先将分液漏斗中下层液体从下口放出,再将上层液体从下口放出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,能在无色透明溶液中大量共存的是
A. Na+、H+、Cl-、OH- B. K+、Na+、CO32-、OH-
C. K+、SO42-、NO3-、MnO4- D. Na+、HCO3-、H+、Ca2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com