
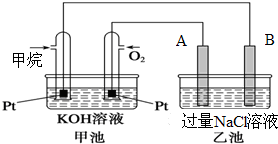
 如图所示是甲烷燃料电池工作时的装置,乙池中的两个电极一个是石墨电极,一个是铜电极,工作时A、B两个电极的质量都不减少,请回答下列问题:
如图所示是甲烷燃料电池工作时的装置,乙池中的两个电极一个是石墨电极,一个是铜电极,工作时A、B两个电极的质量都不减少,请回答下列问题:分析 (1)碱性燃料电池中通入甲烷的一极为原电池的负极,通入氧气的一极为原电池的正极,乙池为电解池,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时A、B两个电极的质量都不减少,A连接原电池的正极,应为电解池的阳极,则应为石墨材料,B为电解池的阴极,为铁电极,结合溶液中的离子放电顺序分析;
(2)乙池中阴极上氢离子得电子,阳极上氯离子失电子生成氯气;
(3)根据电极方程式中电子与物质之间的物质的量关系计算.
解答 解;(1)碱性燃料电池中通入甲烷的一极为原电池的负极,通入氧气的一极为原电池的正极,乙池为电解池,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时A、B两个电极的质量都不减少,A连接原电池的正极,应为电解池的阳极,则应为石墨材料,B为电解池的阴极,为铁电极,A电极上氯离子失电子生成氯气,其电极方程式为:2Cl--2e-═Cl2↑;加入甲烷的铂电极上甲烷失电子生成碳酸根离子和水,其电极方程式为:CH4-8e-+10OH-=CO32-+7H2O;
故答案为:石墨;阳极;2Cl--2e-═Cl2↑;负极;CH4-8e-+10OH-=CO32-+7H2O;
(2)乙池中阴极上氢离子得电子,阳极上氯离子失电子生成氯气,则乙池中总反应的离子方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$=Cl2↑+H2↑+2OH-;
故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$=Cl2↑+H2↑+2OH-;
(3)乙池中阴极上氢离子得电子,2H++2e-═H2↑,析出氢气0.56L(标准状况),其物质的量为$\frac{0.56L}{22.4L/mol}$=0.025mol,则转移电子为0.05mol,正极反应式为2O2+8H++8e-=4H2O,则消耗的氧气为0.0125mol,其体积为0.28L;乙池中总反应的离子方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$=Cl2↑+H2↑+2OH-,根据氢气的物质的量可知,生成的氢氧根离子的物质的量为0.05mol,c(OH-)=$\frac{0.05mol}{0.5L}$=0.1mol/L,所以溶液的pH=13;
故答案为:0.28L;13.
点评 本题考查了原电池原理和电解池原理,明确原电池和电解池电极上发生反应的类型即可分析解答本题,题目难度中等,注意电极反应式的书写与电解质溶液的酸碱性有关.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案科目:高中化学 来源: 题型:选择题
| A. | Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O | B. | NaCl+H2SO4(浓)═NaHSO4+HCl↑ | ||
| C. | C+2H2SO4(浓)═2SO2↑+CO2↑+2H2O | D. | H2SO4+Na2SO3═Na2SO4+H2O+SO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)某可逆反应在不同条件下的反应历程分别为A、B,如图所示.
(1)某可逆反应在不同条件下的反应历程分别为A、B,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 太阳能电池的主要材料是高纯度的二氧化硅 | |
| B. | 铜锌原电池工作时,电子从铜电极沿外电路流向锌电极 | |
| C. | 铅蓄电池的负极为PbO2,属于二次电池 | |
| D. | 锌锰干电池中,锌电极是负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
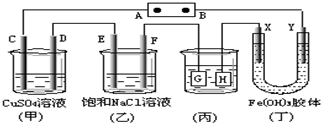 如下图所示的装置,C.D.E.F.X.Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )
如下图所示的装置,C.D.E.F.X.Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )| A. | 电源B极是正极 | |
| B. | 欲用丙装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 | |
| C. | 甲、乙装置的C、D、E、F电极均有单质生成,其物质的量之比为1:2:2:2 | |
| D. | 装置乙中E极附近产生可燃气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
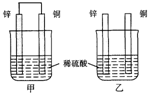
| A. | 两烧杯中铜片表面均无气泡产生 | |
| B. | 甲中铜片是正极,乙中铜片是负极 | |
| C. | 两烧杯中溶液的酸性均减弱 | |
| D. | 甲装置的导线中有电流,电流方向为锌→铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
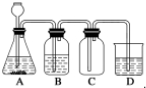
| A. | A 中可用分液漏斗代替长颈漏斗 | |
| B. | A 中缺少加热装置 | |
| C. | B 中盛放的NaOH 溶液可以净化Cl2 | |
| D. | D 中盛放的NaOH 溶液可以吸收尾气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com