
【题目】在铜与稀HNO3的反应中,若有lmol HNO3被还原,则参加反应的铜的物质的量为
A. 8/3mol B. 3/8mol C. 3/2mol D. 3mol
科目:高中化学 来源: 题型:
【题目】下列有关从海带中提取碘的实验原理和装置能达到实验目的的是

A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I的Cl2
D. 用装置丁吸收氧化浸泡液中I后的Cl2尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O]是一复盐,在造纸等方面应用广泛。某兴趣小组采用10.0g废易拉罐(含90%的Al,还含有少量的Fe、Mg等杂质)制备明矾的实验方案如下:
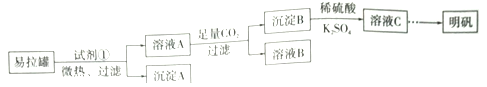
(1)试剂①应选用_____________(填代号)。
a.盐酸 b.H2SO4溶液 c.氯化钠溶液 d.NaOH溶液
(2)易拉罐溶解过程中主要反应的化学方程式为____________________。
(3)溶液B中溶质的主要成分为____________________ (填化学式)。
(4)从溶液C中得到明矾的实验操作步骤为蒸发浓缩、__________(填操作名称)、过滤、洗涤、干燥。如下图所示,蒸发操作中的一处错误是_____________。

(5)该小组在实验完成之后,得到118.5 g明矾,则明矾的回收率为_____________。(已知:明矾的摩尔质量为474g·mol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产和生活密切相关。下列说法错误的是
A.铁粉作食品袋内的脱氧剂,起还原作用
B.大量排放二氧化碳可导致温室效应
C.从海水中提取物质都必须通过化学反应才能实现
D.“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的“碱”是K2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O反应,下列说法正确的是( )
MnCl2+Cl2↑+2H2O反应,下列说法正确的是( )
A. 每消耗1molMnO2生成Cl2的体积为22.4L
B. 氧化剂与还原剂的物质的量之比为1:4
C. 氧化性:MnO2>Cl2
D. 反应中每生成1molCl2时,转移电子的物质的量为4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在海水中主要以I-的形式存在,在地壳中和生活中主要以NaIO3的形式存在,几种粒子之间有如图所示关系,根据图示转化关系推测下列说法不正确的是( )

A. 由图可知氧化性的强弱顺序为Cl2>I2>IO![]()
B. 足量Cl2能使湿润的KI淀粉试纸变白的原因可能是:5Cl2+I2+6H2O===2HIO3+10HCl
C. 途径Ⅱ中若生成1 mol I2,反应中转移的电子数为10NA
D. 可用KI淀粉试纸和食醋检验加碘盐中是否含有碘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表前三周期的一部分:

(1)判断 Y ____ Z _____ R _____(写元素符号)。
(2)写出X的氢化物的化学式:_________,W的氢化物的化学式_________,其沸点比较: ________>________ ______________ (填化学式)
(3)下图是X的基态原子的电子排布图,其中有一个是错误的,它不能作为基态原子的电子排布 图是因为它不符合________。


(4)以上五种元素中,________(填元素符号)元素第一电离能最大。_____元素电负性最大,Y的基态原子的电子排布式为________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知:0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652 kJ的热量。
(1)该反应的热化学方程式为__________________________。
(2)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能/(kJ/mol) | a | b | c | x |
已知白磷的燃烧热ΔH=-d kJ/mol,白磷及其完全燃烧的产物结构如下图所示,则上表中x=______________________(用含有a、b、c、d的代数式表示)。

(II)分别取40 mL的0.50 mol/L盐酸与0.55 mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。

请回答下列问题:
(3)A的仪器名称为_____________。
(4)如下图所示,泡沫塑料板上面有两个小孔,两个小孔不能开得过大,其原因是____________;反应需要测量温度,每次测量温度后都必须采取的操作是____________________。
(5)某学生实验记录数据如下:
实验序号 | 起始温度t1 ℃ | 终止温度t2 ℃ | |
盐酸 | 氢氧化钠 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
已知盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容c=4.18 J/(g·℃)
依据该学生的实验数据计算,该实验测得的中和热ΔH=________;
(6)假定该学生的操作完全同上,实验中改用100 mL 0.5 mol/L盐酸跟100 mL 0.55 mol/L氢氧化钠溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com