
室温下,用0.100 0 mol·L-1NaOH溶液分别滴定体积均为20.00 mL的盐酸和醋酸溶液,滴定曲线如右图。下列说法正确的是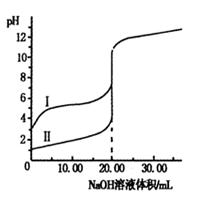
| A.I、Ⅱ分别表示盐酸和醋酸的滴定曲线 |
| B.盐酸和醋酸的浓度均为0.100 0 mol·L-1 |
| C.pH=7时,两种酸所消耗NaOH溶液的体积相等 |
| D.V(NaOH)=20.00mL时,c(Cl一)=c(CH3COO一) |
B
解析试题分析:A、根据图像可知,曲线发生突变时均消耗20.00ml氢氧化钠溶液,这说明醋酸和盐酸的起始浓度均是0.100 0 mol/L。滴定开始时0.1000mol/L盐酸pH=1,0.1000mol/L醋酸pH>1,所以滴定盐酸的曲线是图Ⅱ,滴定醋酸的曲线是图Ⅰ,故A错误;B、根据A中分析可知,盐酸和醋酸的浓度均为0.100 0 mol/L,故B正确;C、醋酸钠水解呈碱性,氯化钠不水解,pH=7时,醋酸所用NaOH溶液的体积小,故C错误;D、V(NaOH)=20.00 mL 时,二者反应生成氯化钠和醋酸钠,醋酸根发生水解,溶液显碱性,则根据电荷守恒可知醋酸根浓度小于氯离子,故D错误,因此答案选B。
考点:考查中和滴定、溶液酸碱性以及离子浓度大小比较


科目:高中化学 来源: 题型:单选题
某温度下,向pH=6的蒸馏水中,加入NaHSO4晶体,保持温度不变,测得溶液的pH为2 ,下列对该溶液的叙述中不正确的是
| A.该温度下加入等体积pH=12的NaOH溶液可使该溶液恰好呈中性 |
| B.由水电离出来的H+的浓度是1.0×10-10mol/L |
| C.加入NaHSO4晶体抑制了水的电离 |
| D.该温度高于25℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
为了同时对农作物施用含有N、P、K三种元素的化肥,对于给定的化肥:①KCl②K2CO3 ③Ca(H2PO4)2④NH4Cl⑤CO(NH2)2,不适合的组合是
| A.②③④ | B.①③④ | C.①③⑤ | D.①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
25 ℃时,水中存在电离平衡:H2O H++OH-,下列关于水的说法,不正确的是( )
H++OH-,下列关于水的说法,不正确的是( )
| A.水的电离是吸热过程 |
| B.向水中加入少量稀硫酸,c(H+)增大,KW不变 |
| C.含H+的溶液显酸性,含OH-的溶液显碱性 |
| D.水是极弱的电解质,在50 ℃时水的pH小于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知在常温下测得浓度均为0.1 mol·L-1的下列三种溶液的pH: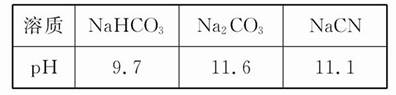
下列说法中正确的是( )
| A.阳离子的物质的量浓度之和:Na2CO3>NaCN>NaHCO3 |
| B.相同条件下的酸性:H2CO3<HCN |
| C.三种溶液中均存在电离平衡和水解平衡 |
D.升高Na2CO3溶液的温度,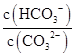 减小 减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1 HCl溶液,滴定曲线如图所示。下列说法不正确的是 ( )。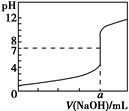
| A.若将盐酸换成同浓度的醋酸溶液,则滴定到pH=7时,a>20.00 |
| B.该滴定也可以用甲基橙作指示剂 |
| C.若用酚酞作指示剂,当滴定到溶液由无色变为红色且半分钟内不褪色时停止滴定 |
| D.滴定过程中,可能存在:c(Cl-)>c(H+)>c(Na+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
盐MN溶于水的过程如图所示: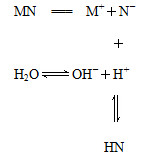
下列说法不正确的是( )
| A.MN是强电解质 |
| B.N-结合H+的能力一定比OH-强 |
| C.该过程中c(OH-)>c(H+) |
| D.溶液中存在c(HN)=c(OH-)-c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下现有的四份溶液:
①0.01 mol/L HCl;②0.01 mol/L CH3COOH;
③pH=12 的氨水;④pH=12的NaOH溶液。
下列说法正确的是( )
| A.②中由水电离出的c(H+)=1×10-12 mol/L |
| B.将①、③混合,若有pH=7,则消耗溶液的体积:③>① |
| C.将②、④等体积混合(体积变化忽略不计),则c(CH3COO-)+c(CH3COOH)=0.01 mol/L |
| D.将四份溶液均稀释10倍后溶液pH:③>④,②<① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com