
| A. | SO2是大气污染物,但葡萄酒中都含有一定量的SO2,SO2既可杀菌又可用来保鲜 | |
| B. | 绿色化学的核心是在化学合成中将原子充分利用,从源头上减少或消除污染 | |
| C. | 茂密树林中的道道光柱,既是一种自然现象又是光学现象,与胶体知识也有关系 | |
| D. | 研发使用高效催化剂,可提高反应中原料的转化率 |
分析 A.依据二氧化硫具有还原性解答;
B.绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的污染;
C.依据胶体的丁达尔效应解答;
D.催化剂只能够改变反应速率,不能影响化学平衡的移动.
解答 解:A.二氧化硫具有还原性,具有抗氧化作用,可使蛋白质变性,起保鲜、杀菌作用,故A正确;
B.绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的污染,故B正确;
C.茂密树林中的道道光柱,既是一种自然现象又是光学现象,与胶体丁达尔效应用有关,故C正确;
D.催化剂只能加快反应速率,对平衡移动无影响,则对反应中原料的转化率无影响,故D错误;
故选:D.
点评 本题考查较综合,涉及催化剂作用、绿色化学概念、胶体的性质与用途等,注重化学与生活、环境的联系,侧重基础知识的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温下,C(s)+H2O(g)?CO(g)+H2(g)不能自发进行,则该反应的△H<0 | |
| B. | 合成氨反应中使用高效催化剂可提高原料转化率 | |
| C. | 电解冶炼铝时需定期更换阳极的石墨电极 | |
| D. | 25℃时,向0.1 mol•L-1 CH3COOH溶液中加水稀释,$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2015年科学家首次利用X射线现测到化学反应过渡态的形成.在固体催化剂表面“抓取”CO分子和O原子,并“配对”生 成CO2分子,下列有关说法正确的是( )
2015年科学家首次利用X射线现测到化学反应过渡态的形成.在固体催化剂表面“抓取”CO分子和O原子,并“配对”生 成CO2分子,下列有关说法正确的是( )| A. | CO与CO2均为酸性氧化物 | |
| B. | 大量CO2的排放可导致酸雨的形成 | |
| C. | CO与O形成化学键过程中有电子转移 | |
| D. | 固体催化剂的使用会降低该反应的焓变 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 酒精溶液可以使蛋白质变性,酒精纯度越高杀菌消毒效果越好 | |
| B. | 在烟花中加入某些金属元素,使焰火更加绚丽多彩 | |
| C. | 苏打水呈弱碱性,可以舒缓胃酸分泌过多时的不适感 | |
| D. | 在葡萄酒中添加微量二氧化硫作抗氧化剂,使酒保持良好品质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
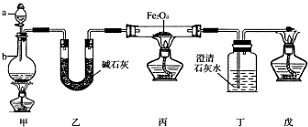
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
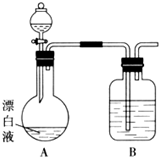 实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件.该小组同学为探究中毒原因进行了如下实验.
实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件.该小组同学为探究中毒原因进行了如下实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH(固体) | B. | 冰醋酸 | C. | HCl | D. | CH3COONa(固体) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
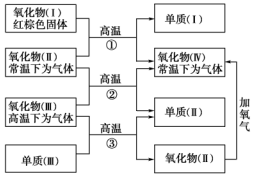 以下一些氧化物和单质之间可发生如图所示的反应:
以下一些氧化物和单质之间可发生如图所示的反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li是最活泼金属,加热生成Li2O2 | |
| B. | 16O2与18O2互为同分异构体 | |
| C. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行 | |
| D. | HF、HCl、HBr、HI的酸性逐渐增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com