
| ||
| ||
| O2 |
| △ |
| 焙烧 |
| 足量稀盐酸 |
| 操作Ⅰ |
| 蒸发结晶过滤 |
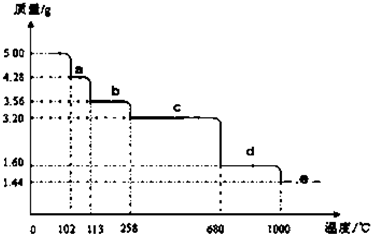
| ||
| ||
| 5.00g |
| 250g/mol |
| 1.44g |
| 18g/mol |
| ||
| 0.16g |
| 32g/mol |
| 0.16g |
| 16g/mol |
| ||


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
| A、1mol H2O所含有的原子数为NA |
| B、常温常压下,32g O2含有的氧原子数为2NA |
| C、常温常压下,11.2L Cl2所含的分子数为0.5NA |
| D、1L 0.1mol/L Na2SO4溶液中所含的Na+为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:Y<Z<W |
| B、气态氢化物的稳定性:Y<W |
| C、X与Y只能形成一种化合物 |
| D、Z2WY3可用来制备木材防火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
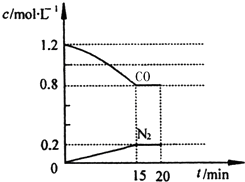 新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.目前降低尾气的可行方法是在汽车排气管上安装催化转化器.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:
新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.目前降低尾气的可行方法是在汽车排气管上安装催化转化器.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com