
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂能加快反应速率 | |
| B. | 压强增大不影响化学反应速率 | |
| C. | 冬天气温低,反应速率降低,对人类危害减小 | |
| D. | 无论外界条件怎样改变,均对此化学反应的速率无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X2+2Y2?XY2 | B. | 3X2+Y2?2X3Y | C. | 2X2+Y2?2X2Y | D. | X2+3Y2?2XY3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu与过量的S混合加热,最终得到CuS | |
| B. | AlCl3、FeCl2、FeCl3均可通过化合反应制得 | |
| C. | 常温下,将27 g A1投入足量18.4 mol•L-1的硫酸中,产生1.5 mol H2 | |
| D. | 将CO2不断通入Ca(OH)2溶液中,最终得到白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在化学反应中,化学能只可以转化为热能 | |
| B. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| C. | 已知2H2(g)+O2(g)=2H2O(l)△H<0,当反应达平衡后升高温度,反应逆向移动,逆反应速率增大,正反应速率减小 | |
| D. | 合成氨反应N2+3H2?2NH3,当N2、H2、NH3浓度相等时该反应达到了最大限度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
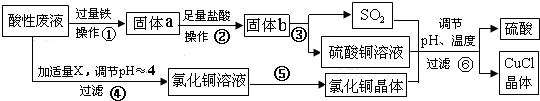
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com