
 MnO2+Zn+2H2SO4��
MnO2+Zn+2H2SO4��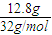 ×��2-0��=0.8mol���ӣ���B��ȷ��
×��2-0��=0.8mol���ӣ���B��ȷ��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��1�����̿���п�������Ṳ�ȣ�MnO2+ZnS+2H2SO4![]() MnSO4+ZnSO4+S+2H2O��
MnSO4+ZnSO4+S+2H2O��
��2����ȥ��Ӧ������еIJ����
��3�������ҺMnSO4+ZnSO4+2H2O![]() MnO2+Zn+2H2SO4
MnO2+Zn+2H2SO4
����˵������ȷ����
A.���裨1����MnO2��H2SO4����������
B.���裨1����ÿ����
C.���ʱMnO2������������
D.�����������п�ѭ��ʹ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��п��ZnS������80%��FeS��CuS��CdS������Լռ2%��
MnO2��Zn������ɵ�ص�ԭ�ϡ���ⷨ����MnO2��ͳ�Ĺ�����Ҫ����Ϊ�����̿�ӽ�̿��ԭ���գ���H2SO4���������ϣ�����Һ������Ȼ���⣬������������MnO2��
�����п�Ĵ�ͳ����Ϊ����п��������������ٻ�ԭ�ô�п��

�����Ȼ�ԭ���ƵõĴ�п�������ᣬ�ٵ��ZnSO4��Һ����������Ϊ99.95%��п��
90�������MnO2��Zn���¹�����ͨ�������MnO2��Zn��
![]()
![]()
�Իش��������⡣
(1)��֪�ڵڢٲ��з����˷�Ӧ��
MnO2+ZnS+2H2SO4====MnSO4+ZnSO4+S+2H2O
�ݴ�д���ڢٲ���Ӧ��MnO2��CuS���ᷴӦ�����ӷ���ʽ��__________�����̿���Al2O3����������ӷ���ʽ��______________________________��
(2)��ƷCΪ____________�����ڢ۲����ʱ����·��ͨ��1 mol����ʱ����������__________�������ʵ���Ϊ__________��
(3)�Դӻ����������������ĵĽǶȣ�����90����¹����봫ͳ������Ƚ�����Щ�ŵ㡣
____________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�����ʡ�����и���������ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
MnO2��Zn��������ͨ�ɵ�ص���Ҫԭ�ϣ���ҵ�������̿���Ҫ�ɷ�MnO2������п����Ҫ�ɷ�ZnS������ȡ��
�ٽ����̿���п�������Ṳ�ȣ�MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O��
�ڳ�ȥ��Ӧ������еIJ����
�۵�����MnSO4+ZnSO4+2H2O
 MnO2+Zn+2H2SO4
MnO2+Zn+2H2SO4
����˵���������
A���ɵ����һ�ֽ���ѧ��ת��Ϊ���ܵ�װ��
B������۵��ʱMnO2�����������ɣ��缫��ӦΪ��Mn2+-2e-+2H2O=MnO2+4H+
C�������ÿ����12.8g S��������ת��0.8mol����
D������۵ķ�ӦҲ������Ƴ�ԭ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010�걱��������������ѧ�ڻ�ѧ�ۺ���ϰ��һ�� ���ͣ�ѡ����
MnO2��Zn������ɵ�ص���Ҫԭ�ϣ���ҵ�������̿����п����������MnO2��Zn�Ļ�������Ϊ��
�� ���̿���п�������Ṳ�ȣ� MnO2��ZnS��2H2SO4��MnSO4��ZnSO4��S��2H2O
�� ��ȥ��Ӧ������еIJ�����
 �� �����ҺMnSO4��ZnSO4��2H2O
MnO2��Zn��2H2SO4
�� �����ҺMnSO4��ZnSO4��2H2O
MnO2��Zn��2H2SO4
����˵������ȷ����
A���������MnO2��H2SO4����������
B���������ÿ����12��8g S������ת��0��8mol����
C�����裨3���е��ʱMnO2������������
D�������������п�ѭ��ʹ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com