
【题目】氰化物有剧毒,我国工业废水中氰化物(CN-)的最高允许排放浓度为0.5 mg/L。对废水中CN-的处理方法是:在碱性条件下,用Cl2将废水中的CN-转化成N2和CO2等,使废水得到净化。发生的反应为2CN-+8OH-+5Cl2===2CO2+N2+10Cl-+4H2O。下列有关说法不正确的是( )
A. 上述反应中氧化产物有N2和CO2
B. 经测定,NaCN的水溶液呈碱性,说明CN-能促进水的电离
C. 若上述反应生成0.4 mol CO2,则溶液中阴离子增加的物质的量为2 mol
D. 现取1 L含CN-1.02 mg/L的废水,至少需用5.0×10-5 mol Cl2处理后才符合排放标准
【答案】C
【解析】
反应2CN-+8OH-+5Cl2===2CO2+N2+10Cl-+4H2O中,Cl元素的化合价由0降低为-1价,N元素的化合价由-3价升高为0,C元素的化合价由+2价升高为+4价,该反应中转移10e-,以此解答。
A.C、N元素化合价都升高,则氧化产物有N2和CO2,故A正确;
B.NaCN的水溶液呈碱性,说明CN-水解促进水的电离,为强碱若酸盐,故B正确;
C.由反应可以知道,生成2mol CO2的同时,生成10molCl-,反应前后阴离子数目不变,则当有0.4 mol CO2生成时,溶液中阴离子的物质的量不变,故C错误;
D. 1 L含CN-1.02mg/L的废水,要达到排放标准,则反应中就必须消耗1.02mg-0.5mg=0.52mgCN-,则根据方程式可知,需要氯气的物质的量是![]() 2.5=5.0
2.5=5.0![]() 10-5mol,故D正确。
10-5mol,故D正确。
故答案选C。


科目:高中化学 来源: 题型:
【题目】银的冶炼有很多方法, 在《 天工开物》 均有记载, 而现代流行的“ 氰化法”, 用 NaCN溶液浸出矿石中的银的方法是最常用的方法。 该方法具备诸多优点: 银的回收率高; 对游离态和化合态的银均能浸出; 对能源消耗相对较少; 生产工艺简便等, 但氰化物通常有毒。 其炼制工艺简介如下:

(1)矿石需要先进行破碎、 研磨, 其目的是__________。
(2)写出该工艺的一个明显的缺点__________ 。
(3)用 NaCN 浸泡矿石( 该矿石是辉银矿, 其主要成分是 Ag2S) 时, 反应容器处于开口状态, 产生的银以[Ag(CN)2]- 形式存在, 硫元素被氧化至最高价, 试写出主要反应的离子方程式__________。
(4)银往往和锌、 铜、 金等矿伴生, 故氰化法得到的银中往往因含有上述金属而不纯净, 需要进一步纯化, 从而获得纯净的银。 其中方法之一就是进行电解精炼, 在精炼过程中, 含有杂质的银作__________极( 填“阴” 或“阳”), 该电极上发生的主要反应式为__________, 金以__________形式存在。
(5)有人提出了另外的提纯银的方案, 先将锌粉还原后的混合金属用略过量的硝酸溶解, 通过精确调整溶液的 pH 来进行金属元素分离, 已知:
①溶解后的离子浓度如下表:
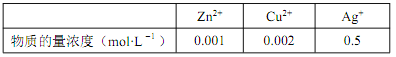
②某些金属离子的氢氧化物 Ksp如下:
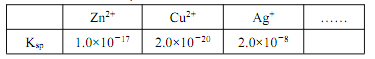
( 已知 lg2=0.3),该设计方案_______(填“ 可行” 或“ 不可行”),其原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于处于化学平衡状态的反应C(s)+H2O(g)![]() CO(g)+H2(g);ΔH>0,既要提高反应速率又要提高H2O的转化率,下列措施中可行的是
CO(g)+H2(g);ΔH>0,既要提高反应速率又要提高H2O的转化率,下列措施中可行的是
A. 增大H2O(g)的浓度 B. 升高温度
C. 降低压强 D. 增加碳的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g)![]() 2N2(g)+3H2O(g) △H<0,在恒容的密闭容器中,下列有关说法正确的是
2N2(g)+3H2O(g) △H<0,在恒容的密闭容器中,下列有关说法正确的是
A. 平衡时,其他条件不变,升高温度可使该反应的速率加快,平衡常数增大
B. 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C. 单位时间内消耗NO和N2的物质的量比为1∶2时 ,反应达到平衡
D. 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在苯的同系物中.加入少量酸性高锰酸钾溶液.振荡后褪色.正确的解释是( )
A.苯的同系物分子中.碳原子数比苯多
B.苯环受侧链影响.易被氧化
C.侧链受苯环影响.易被氧化
D.由于侧链与苯环的相互影响.使侧链和苯环均易被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修3:物质的结构与性质)
钛有“生物金属”和“未来金属”之称,钛及其化合物的应用正越来越受到人们的关注。
(1)基态钛原子外围电子的轨道表达式为___________。与钛同周期的元素中,基态原子的未成对电子数与钛相同的有___种。
(2)金属钛的熔点、硬度均比铝大,可能的原因是____。
(3)TiCl4是氯化法制取钛的中间产物。TiCl4和SiCl4在常温下都是液体,分子结构相同。采用蒸馏的方法分离TiCl4和SiCl4的混合物,先获得的馏分是__________ (填化学式)。

(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯等的聚合,其结构如图所示。
①组成该物质的元素中,电负性最大的是__________ (填元素名称)。
②M中碳原子的杂化形式有___________种。
③M中不含__________ (填字母代号)。
a.π键 b.σ键 c.配位键
d.氢键 e.离子键

(5)①金属钛晶体中原子采用面心立方最密堆积,则晶胞中钛原子的配位数为_____。
②设钛原子的直径为d cm,用NA表示阿伏加德罗常数的值,钛原子的摩尔质量为M g·mol-1,则晶体钛的密度为________g·cm-3。
③金属钛晶胞中有若干个正四面体空隙,如图中a、b、c、d四个钛原子形成一个正四面体,其内部为正四面体空隙,可以填充其他原子。若晶胞中所有的正四面体空隙中都填充氢原子,那么形成的氢化钛的化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处于平衡状态的反应2 H2 S(g) ![]() 2H2(g)+S2(g)
2H2(g)+S2(g) ![]() H>0,不改变其他条件的情况下合理的说法是
H>0,不改变其他条件的情况下合理的说法是
A.加入催化剂,反应途径将发生改变,![]() H也将随之改变
H也将随之改变
B.升高温度,正逆反应速率都增大,H2S分解率也增大
C.增大压强,平衡向逆反应方向移动,将引起体系温度降低
D.若体系恒容,注人一些H2后达新平衡,H2浓度将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明硫酸为强酸的实验事实是 ( )
A.能与酸碱指示剂作用B.能与磷酸钙反应生成磷酸
C.能与金属锌反应生成氢气D.能与食盐固体共热产生气体氯化氢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com