
| A、标准状况下,22.4 L水所含的水分子数为NA |
| B、1 mol?L-1FeCl3溶液中所含Cl-的数目为3NA |
| C、25℃,1.01×105Pa,14g氮气所含的氮原子数为NA |
| D、1 mol Na2SO4溶于水,所得溶液中Na+的数目为NA |


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
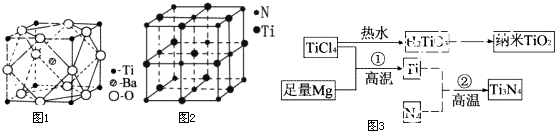
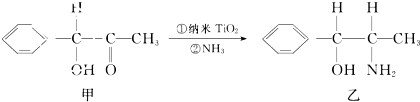
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3溶液加水稀释后,恢复至原温度,pH和KW均减小 |
| B、常温,在NH4Cl溶液中,当溶液中c(NH4+)=c(Cl-),pH=7 |
| C、pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等 |
| D、pH=2的一元强酸和pH=12的一元强碱等体积混合c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L的 NaHCO3溶液中:c (Na+)+c (H+)+C(H2CO3)=c (HCO3-)+c(CO32-)+c (OH-) |
| B、等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:C(Na+)>C(HX)>C(X-)>C(H+)>C(OH-) |
| C、在纯碱溶液中存在:C(OH-)=C(H+)+C(HCO3-)+2C(H2CO3) |
| D、0.1mol/L HCOOH溶液中:C(HCOO-)+C(OH-)=C(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后一段时间,在D极上出现红色物质.则下列说法中正确的是( )
如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后一段时间,在D极上出现红色物质.则下列说法中正确的是( )| A、电源B极是正极 |
| B、装置丁中X极附近红褐色变浅,说明氢氧化铁胶粒带负电荷 |
| C、欲用丙装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 |
| D、甲、乙装置的C、D、E、F电极均有单质生成,其物质的量之比为1:2:2:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、44% | B、48% |
| C、56% | D、无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③>①>②>④ |
| B、②>①>④>③ |
| C、④>③>②>① |
| D、①>③>④>② |
查看答案和解析>>
科目:高中化学 来源: 题型:
 2013年初,全国各地多个城市都遭遇“十面霾伏”,造成“阴霾天”的主要根源之一是汽车尾气和燃煤尾气排放出来的固体小颗粒.
2013年初,全国各地多个城市都遭遇“十面霾伏”,造成“阴霾天”的主要根源之一是汽车尾气和燃煤尾气排放出来的固体小颗粒.| 催化剂 |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/xl0-4mol L-1 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/xl0-3mol L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com