
| A. | 700C时,向纯水中加人H3PO4后,水的Kw减小 | |
| B. | 700C的Na2CO3溶液中c(Na+)>c(CO32-)c(HCO3-)>c(OH-)>c(H+) | |
| C. | 700C的H2S04溶液中c(H+)=c(OH-)+2c(SO42-) | |
| D. | 将室温下0.1 mol/L的NaOH溶液加热至700C时,c(OH-)/c(H+)随之增大 |
分析 A、水的离子积Kw只受温度的影响;
B、碳酸根的水解分两步进行,且以第一步为主;
C、根据电荷守恒来分析;
D、将室温下0.1 mol/L的NaOH溶液加热至70℃时,Kw增大,而c(OH-)不变.
解答 解:A、水的离子积Kw只受温度的影响,和溶液的酸碱性无关,故向纯水中加入磷酸,Kw不变,故A错误;
B、Na2CO3溶液碳酸根离子水解导致溶液显示碱性,碳酸根的水解分两步进行,且以第一步为主,其中离子浓度大小顺序是:c(Na+)>c(CO32-)>>c(HCO3-)>c(H+),故B错误;
C、硫酸溶液中,阴离子为氢氧根和硫酸根,阳离子为氢离子,根据电荷守恒可知有:c(H+)=c(OH-)+2c(SO42-),故C正确;
D、将室温下0.1 mol/L的NaOH溶液加热至70℃时,Kw增大,而c(OH-)不变,故c(H+)变大,则两者的比值变小,故D错误.
故选C.
点评 本题考查了溶液中的离子浓度大小比较和三个守恒的运用,难度不大,应注意的是Kw只受温度的影响.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 铜溶于0.5 mol•L-1的硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| B. | 工业上将Cl2通入石灰乳中制漂白粉:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | 向NH4HSO4溶液中滴加少量Ba(OH)2的溶液:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | H2C2O4(弱酸)溶液中加入酸性KMnO4溶液:2MnO42-+5H2C2O4=2Mn2++10CO2↑+2H2O+6OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 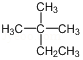 的系统命名为2-甲基-2-乙基丙烷 的系统命名为2-甲基-2-乙基丙烷 | |
| B. | 用酸性KMnO4溶液可以确定CH2=CH-CHO中含有C=C双键 | |
| C. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| D. | 在一定条件下,乙酸、氨基乙酸、蛋白质均能与NaOH发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
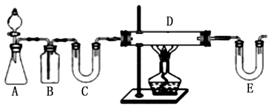

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 36g镁在足量的氮气中完全燃烧共转移的电子数为3NA | |
| B. | 室温下,21.0g乙烯和丁烯的混合气体中含有的C-H共价键数目为3NA | |
| C. | 标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为3NA | |
| D. | 1 molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞试液变红的溶液:Na+、Cl-、SO${\;}_{4}^{2-}$、Fe3+ | |
| B. | 常温下$\frac{{K}_{w}}{c({H}^{+})}$=0.1mol•L-1的溶液:K+、Na+、SiO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$ | |
| C. | 使紫色石蕊试液变红的溶液:Fe2+、Mg2+、MnO${\;}_{4}^{-}$、Cl- | |
| D. | 澄清透明溶液:Al3+、Na+、SO${\;}_{4}^{2-}$、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高a的反应温度,乙醇的转化率增大 | |
| B. | 由b可知:乙醇的燃烧热为13.8 kJ•mol-1 | |
| C. | 2H2(g)+O2(g)=2H2O(g)△H=+485.6 kJ•mol-1 | |
| D. | 制取等量的氢气,途径b消耗的能量更多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 块状固体药品的取用:一横、二放、三慢竖 | |
| B. | 液体药品的倾倒:瓶塞倒放、紧挨瓶口、缓慢倒入 | |
| C. | 分液的操作:静置分层后将分液漏斗中下层液从下口放出,再将上层液从上口倒出 | |
| D. | 冷凝管的使用:冷却水下口进,上口出 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

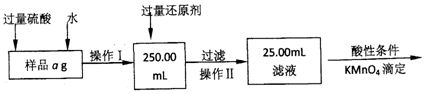
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com