
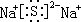 .
.分析 有A、B、C、D、E五种短周期主族元素,原子序数由A到E逐渐增大.A的最外层电子数是次外层电子数的2倍,则A原子有2个电子层,最外层电子数为4,则A为碳元素;B的阴离子和C的阳离子与氖原子的电子层结构相同,则C处于第三周期、B处于第二周期,在通常状况下,B的单质是气体,0.1molB的气体与足量的氢气完全反应共有0.4mol电子转移,B元素表现-2价,则B为O元素;C的单质在点燃时与B的单质充分反应,生成淡黄色的固体,此淡黄色固体能与AB2反应可生成B的单质,则C为Na;D的气态氢化物与其最高价含氧酸间能发生氧化还原反应,E的原子序数最大,则D为S元素,E为Cl,以此来解答.
解答 解:有A、B、C、D、E五种短周期主族元素,原子序数由A到E逐渐增大.A的最外层电子数是次外层电子数的2倍,则A原子有2个电子层,最外层电子数为4,则A为碳元素;B的阴离子和C的阳离子与氖原子的电子层结构相同,则C处于第三周期、B处于第二周期,在通常状况下,B的单质是气体,0.1molB的气体与足量的氢气完全反应共有0.4mol电子转移,B元素表现-2价,则B为O元素;C的单质在点燃时与B的单质充分反应,生成淡黄色的固体,此淡黄色固体能与AB2反应可生成B的单质,则C为Na;D的气态氢化物与其最高价含氧酸间能发生氧化还原反应,E的原子序数最大,则D为S元素,E为Cl.则
(1)A为碳元素,最高价氧化物为CO2,结构式为O=C=O;B为氧元素,在周期表中的位置是第二周期VIA族,
故答案为:O=C=O;第二周期VIA族;
(2)B单质与C单质在点燃时反应的生成物为Na2O2,含有离子键、共价键;C与D 能形成化合物是硫化钠,含离子键,则电子式为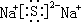 ,
,
故答案为:离子键、非极性共价键(或共价键);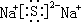 ;
;
(3)D元素的低价氧化物为二氧化硫,与氯气的水溶液反应的离子方程式为SO2+Cl2+2H2O=H2SO4+2HCl,
故答案为:SO2+Cl2+2H2O=H2SO4+2HCl;
(4)同周期自左而右元素非金属性增强,故非金属性Cl>S,
a.单质状态属于物理性质,不能比较元素非金属性,故a错误;
b.氢化物稳定性与元素非金属性一致,氯化氢比硫化氢稳定,说明氯的非金属性更强,故b正确;
c.与变价金属反应可以根据产物中金属化合价判断非金属元素的非金属性强弱,Na不是变价金属,不能判断硫与氯的非金属性强弱,故c错误;
d.最高价含氧酸的酸性与中心元素的非金属性一致,故d正确;
e.硫不能与HCl反应生成氯气,故e错误;
故答案为:Cl;bd.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、元素化合物知识推断元素为解答的关键,侧重分析与应用能力的考查,注意过氧化钠的性质及应用,题目难度不大.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 用肥皂洗涤久置石灰水的试剂瓶 | B. | 用酒精清洗残留碘的试管 | ||
| C. | 用洗涤剂清洗餐具上的油污 | D. | 用汽油清洗沾在手上的油漆 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素在周期表中的位置,反映了元素的原子结构和元素性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素性质.如图是元素周期表的一部分.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,D原子的原子结构示意图为
,D原子的原子结构示意图为 ,C+离子的结构示意图为
,C+离子的结构示意图为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若a<b,则c(OH-)<c(H+) | B. | 若a>b,则c(NH4+)>c(Cl-) | ||
| C. | 若a>b,则c(OH-)>c(H+) | D. | 若a=b,则c(NH4+)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所得液体属于纯净物 | B. | 该红褐色液体能产生了达尔效应 | ||
| C. | 所得液体中分散质粒子只有Fe(OH)3 | D. | 上述实验过程中没有发生化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05 mol液态KHSO4中含有0.05 NA个阳离子 | |
| B. | 氢氧燃料电池正极消耗22.4 L气体时,电路中通过电子的数目为4 NA | |
| C. | 常温下,100 mL 1 mol•L-l盐酸与4.6 g钠反应生成H2分子数目为0.1NA | |
| D. | 在电解精炼粗铜的过程中,当阴极析出32 g铜时转移电子数目为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com