
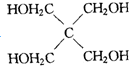
| A. | CH3OH | B. | CH3CH2CH2OH | C. | 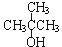 | D. | 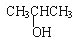 |
分析 醇发生消去反应的结构特点是:只有羟基相连碳的相邻碳上有氢原子的才能发生消去反应,形成不饱和键;醇发生氧化反应的结构特点是:只有羟基相连碳的碳上有氢原子的才能发生氧化反应.
解答 解:A.CH3OH不能发生消去反应,故A错误;
B.CH3CH2CH2OH发生消去反应生成丙烯,发生氧化反应生成丙醛,故B正确;
C. 不能氧化生成相应的醛或酮,故C错误;
不能氧化生成相应的醛或酮,故C错误;
D.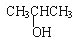 不能氧化生成相应的醛,能氧化生成酮,故D错误.
不能氧化生成相应的醛,能氧化生成酮,故D错误.
故选B.
点评 本题考查醇的消去反应和氧化反应的特点,难度适中,注意醇发生消去反应的结构特点是:只有羟基相连碳的相邻碳上有氢原子的才能发生消去反应,形成不饱和键;醇发生氧化反应的结构特点是:只有羟基相连碳的碳上有氢原子的才能发生氧化反应.


 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
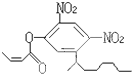 阿乐丹的结构简式可简写为如图,它在稀酸作用下能水解生成两种有机物,这两种有机物可能共同具有的性质是( )
阿乐丹的结构简式可简写为如图,它在稀酸作用下能水解生成两种有机物,这两种有机物可能共同具有的性质是( )| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ②③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液:Cu2+、K+、MnO4-、SO42- | |
| B. | 能溶解Al2O3的溶液:Na+、Ca2+、HCO3-、NO3- | |
| C. | 常温下c(OH-)=1×10-13mol•L-1的溶液:NH4+、Al3+、SO42-、Cl- | |
| D. | 含0.1 mol•L-1 NO3-的溶液:H+、Fe2+、Mg2+、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
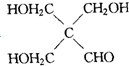
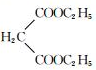 $→_{CH_{3}CH_{2}ONa}^{BrCH_{2}CH_{2}CH_{2}Br}$
$→_{CH_{3}CH_{2}ONa}^{BrCH_{2}CH_{2}CH_{2}Br}$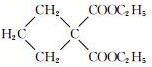 $→_{ii.H+/△}^{i.H_{2}O,OH-}$
$→_{ii.H+/△}^{i.H_{2}O,OH-}$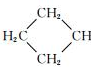 -COOH
-COOH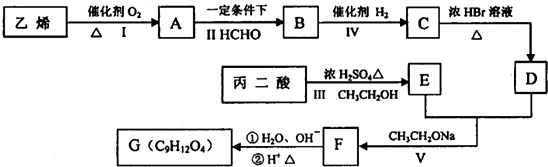
 G
G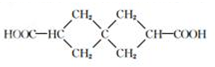
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定是IIA元素 | |
| B. | 一定是金属元素 | |
| C. | 一定是正二价元素 | |
| D. | 可能是金属元素,也可能是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
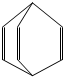 烯料是人们装修房屋时常用的物质,其中桶烯就是其中倍受青睐的一种,其结构简式如图所示,有关桶烯说法不正确的是( )
烯料是人们装修房屋时常用的物质,其中桶烯就是其中倍受青睐的一种,其结构简式如图所示,有关桶烯说法不正确的是( )| A. | 不慎将桶烯撒倒地面瓷砖上,可用火烤干 | |
| B. | 1mol桶烯在一定条件下能与3molCl2发生加成反应 | |
| C. | 桶烯与苯乙烯互为同分异构体 | |
| D. | 桶烯可用做其它有机涂料的溶剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇分子中的官能团为羟基 | B. | 可由乙烯通过加成反应制取 | ||
| C. | 与丙三醇互为同系物 | D. | 通过取代反应可制取乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,但使用过量会使人中毒.某学习小组针对亚硝酸钠设计了如下实验:
亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,但使用过量会使人中毒.某学习小组针对亚硝酸钠设计了如下实验:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com