
某澄清溶液X中可能含有大量Cl 、SO32—、SO42—、Fe2+、Fe3+、K+,按如下流程进行实验:
、SO32—、SO42—、Fe2+、Fe3+、K+,按如下流程进行实验:

则下列说法中正确的是
A.现象3不能证明X中是否含有SO42—
B.现象2气体C中至少有一种是CO2或SO2,操作Ⅰ为过滤
C.现象5表明X溶液中一定含有Cl
D.现象1表明X溶液显酸性,沉淀D为Fe(OH)3
D
【解析】
试题分析:根据题意知,某澄清溶液X中加入紫色石蕊,溶液变红色,说明X溶液呈酸性,溶液中一定不含SO32—,Fe2+、Fe3+至少存在一种;向其中加入过量硝酸钡溶液,生成的白色沉淀A一定为硫酸钡,溶液中一定含有SO42—,气体C为Fe2+与氢离子、硝酸根发生氧化还原反应生成的一氧化氮,原溶液一定含有Fe2+,溶液B中一定含有Fe3+;加入过量氢氧化钠溶液,过滤,得沉淀D为氢氧化铁,无色溶液E中含有过量的氢氧根,加入足量硝酸银溶液,生成白色沉淀F可能是氢氧化银或氯化银和氢氧化银的混合物。由上述分析知,A、现象3能证明X中一定含有SO42—,错误;B、现象2气体C中是氮的氧化物,操作Ⅰ为过滤,错误;C、现象5表明X溶液中不一定含有Cl ,错误;D、现象1表明X溶液显酸性,沉淀D为Fe(OH)3,正确。
,错误;D、现象1表明X溶液显酸性,沉淀D为Fe(OH)3,正确。
考点:考查离子检验和离子推断。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源:2013-2014重庆市下学期期中考试高二化学试卷(解析版) 题型:填空题
(10分)Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,Q、W、Z是非金属元素。五种元素核电荷数之和为55,对应原子最外层电子数之和为21。W、Z最外层电子数相同,但Z的核电荷数是W的2倍。
(1)Q在周期表中位于第 周期 族。
(2)X、Y各自的最高价氧化物对应的水化物可以发生反应生成盐和水,请写出该反应的离子方程式: 。
(3)X单质能在W单质中燃烧可生成化合物R,R的电子式 ___,该物质所含有的化学键的类型为 。
(4)Z的氢化物与W的氢化物发生反应生成Z单质和水,写出其化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市下学期期中考试高一化学试卷(解析版) 题型:选择题
PH3是一种无色剧毒气体,其分子结构和NH3相似。下列判断错误的是( )
A.PH3分子呈三角锥形
B.PH3分子是极性分子
C.PH3分子中所有原子最外层都满足8e—结构
D.PH3分子稳定性低于NH3分子,因为N-H键键长更短、键能更高
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市5月高三月考理综化学试卷(解析版) 题型:选择题
下列实验操作与预期的实验目的或结论均正确的是
选项 | 实验操作 | 预期的实验目的或结论 |
A | 对某白色固体进行焰色反应实验,火焰呈黄色 | 该物质为钠盐 |
B | SO2通入某红色溶液中,溶液褪色 | 该溶液为品红溶液 |
C | 蔗糖溶液中加入少量稀硫酸加热,然后加银氨溶液再加热 | 验证蔗糖在强酸性条件下是否发生水解 |
D | pH均为1的盐酸、醋酸溶液分别用蒸馏水稀释m倍、n倍后的pH相同 | m<n |
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市名校联盟高三三诊理综化学试卷(解析版) 题型:实验题
(15分)某研究小组设计如下装置分离CO和CO2的混合气体并探究CO还原氧化铜的产物和过氧化钠的性质。已知氯化钯(PdCl2)溶液遇CO气体会产生黑色沉淀(金属单质)。夹持装置未画出。

(题9图)
(1)试剂X、Y的焰色反应均呈黄色,则X、Y可能是 、 .
(2)连接装置、检验气密性并装好药品后,关闭分液漏斗活塞和K3,打开K1、K2,分离出CO,当观察到 现象时,可对C装置进行加热操作,反应产物为红色固体。
(3)查询资料获得以下信息:①Cu2O为红色固体;②常温下,Cu2+在溶液中稳定,Cu+易在酸性条件下发生反应:2Cu+ =Cu2++Cu。
甲、乙两组同学取上述红色固体(用M代表)进行实验,探究其成分:
组别 | 实验操作 | 实验现象或数据 | 结 论 |
甲 | ① 向a g M中加入一定量稀硫酸,充分搅拌; ② 继续滴加稀硫酸至过量, 充分反应. | ①固体明显减少; ②仍然有一定量固体,溶液呈蓝色 | ①M中一定有Cu2O; ②M中一定有Cu. |
乙 | 将甲实验后所得溶液过滤 将滤渣洗涤、干燥、称量 | 滤渣质量为 | M为Cu和Cu2O的混合物 |
(i)乙组同学认为甲组同学所得结论不可靠,其理由是 .
(ii)甲组同学配合乙组同学进行了计算,认为乙组同学的结论是正确的,并得出M中Cu和Cu2O的物质的量之比是 .
(4)C装置反应结束后,欲从混合气体中分离出CO2,需进行的主要操作是 .实验过程中D装置产生白色沉淀的离子方程式为 .
(5)Z试剂为混有KI的苯溶液,则E装置中可能产生的现象是 .
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市高三5月月考理综化学试卷(解析版) 题型:实验题
(12分)为验证氧化性:Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕)实验过程如下:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4.
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中的溶液变黄时,停止加热,夹紧弹簧夹K2.
Ⅳ.打开活塞b,使约2ml的溶液流入D试管中,检验其中的离子.
V.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3.
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子.
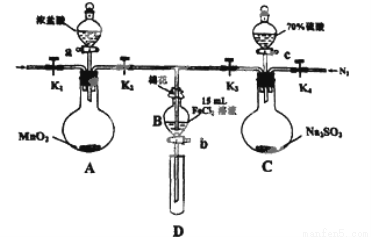
(1)过程Ⅰ的目的是______________________。
(2)棉花中浸润的溶液为__________________。
(3)A中发生反应的化学方程式为__________________________________。
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是______________
(5)过程Ⅵ中检验B溶液中是否含有硫酸根的操作是________________________________
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是
| 过程IV B溶液中含有的离子 | 过程VI B溶液中含有的离子 |
甲 | 有Fe3+无Fe2+ | 有SO42﹣ |
乙 | 既有Fe3+又有Fe2+ | 有SO42﹣ |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市高三5月月考理综化学试卷(解析版) 题型:选择题
萨罗(Salo1)是一种消毒剂,属于芳香族含氧衍生物,其分子模型如下图所示(图中球与球之间的连线代表化学键,如单键、双键等)。则下列说法不正确的是:
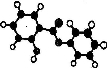
A.萨罗的分子式为Cl3Hl0O3
B.1mol萨罗与浓溴水反应,需要消耗3mol Br2
C.1mol萨罗发生水解,需要消耗3mol NaOH
D.萨罗经水解、分离、提纯可得到纯净的苯酚和水杨酸(邻羟基苯甲酸)
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市主城七区高三下学期第二次联考理综化学试卷(解析版) 题型:简答题
(14分)A、B、C、D、E、F是原子序数依次增大的六种短周期元素。F的单质在D2中燃烧的产物可使品红溶液褪色;B的单质在D2中燃烧可生成BD和BD2两种气体;E的原子序数为B的两倍;A元素的一种核素中不含中子。请回答下列问题:
(1)C的单质分子的结构式为 ;ED的电子式为 。
(2)E单质在BD2中剧烈燃烧生成黑白两种固体,该反应的化学方程式为 。
(3)FD2气体通入BaCl2和HNO3的混合溶液中,生成白色沉淀和无色气体CD,有关反应的离子方程式为 ,由此可知CD和FD2中还原性较强的是 (填化学式)。
(4)A、C、D、F四种元素按原子个数比为5 :1 :4 :1形成化合物甲,则甲的化学式为 。将0.01mol/L的甲溶液与0.03mol/L的Ba(OH)2溶液等体积混合得到沉淀,已知该沉淀的Ksp=x ,则混合溶液中酸根离子的浓度为 mol / L(用含x的代数式表示,混合后溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆一中高一下学期期末考试化学试卷(解析版) 题型:实验题
(16分)(原创)硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图1。
已知:Na2S2O3在酸性溶液中不能稳定存在。
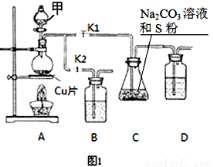
(1)步骤1:打开K1、关闭K2,向圆底烧瓶中加入足量甲并加热,则试剂甲为:
。
(2)步骤2:始终保持C中溶液呈碱性,反应一段时间后,硫粉的量逐渐减少,打开K2、关闭K1并停止加热。
①C中溶液须保持呈碱性的原因:若呈酸性,则 、
。(用离子方程式表示)
②装置B、D的作用是 。
步骤3:将C中所得混合物分离提纯后得产品。
(3)利用反应2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2也能制备Na2S2O3。所需仪器如图2,按气流方向连接各仪器,接口顺序为: →g,h→ , → , →d。
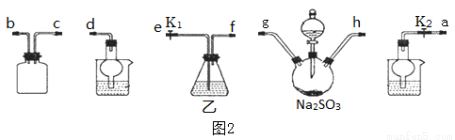
(4)装置乙盛装的试剂是:_____________________________。
(5)Na2S2O3还原性较强,工业上常用作除去溶液中残留的Cl2,该反应的离子方程
式为: 。
(6)请设计简单的实验方案,证明上述残留的Cl2被还原成了Cl—:____________
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com