
| A. | 碳酸钙溶于盐酸:CO32-+2H+═H2O+CO2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | FeCl3溶液中加入铁粉:Fe+Fe3+═2Fe2+ | |
| D. | 过氧化钠遇水:2Na2O2+2H2O═4Na++4OH-+O2↑ |
分析 A.碳酸钙为难溶物,离子方程式中不能拆开;
B.氨水为弱碱,二者反应生成氢氧化铝沉淀;
C.离子方程式两边正电荷不相等,违反了电荷守恒;
D.过氧化钠与水反应生成氢氧化钠和氧气.
解答 解:A.碳酸钙与稀盐酸反应生成氯化钙、二氧化碳气体和水,正确的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,故A错误;
B.氯化铝与氨水反应生成氢氧化铝沉淀和氯化铵,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故B错误;
C.FeCl3溶液中加入铁粉,反应生成氯化亚铁,正确的离子方程式为:Fe+2Fe3+═3Fe2+,故C错误;
D.过氧化钠与水反应的离子方程式为:2Na2O2+2H2O═4Na++4OH-+O2↑,故D正确;
故选D.
点评 题考查了离子方程式的正误判断,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
 常温下,向某浓度的草酸(H2C2O4)溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-三种微粒的物质的量的分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )
常温下,向某浓度的草酸(H2C2O4)溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-三种微粒的物质的量的分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )| A. | 从上图分析知草酸氢钾溶液中存在3个平衡 | |
| B. | 常温下:H2C2O4的Ka1=10-1.2、Ka2=10-4.2 | |
| C. | 图中任意一点都有:c(K+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-) | |
| D. | 滴定过程中水的电路程度:点(1.2,0.5)<点(4.2,0.5) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以上各物质对应的计量数依次为1、6、14、3、2、7 | |
| B. | Cr2O72-发生了还原反应 | |
| C. | □处对应的物质是H2O | |
| D. | 若0.1mol Cr2O72-参加反应,产生氯气物质的量是0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-+H2O?H2CO3+OH- | B. | HS-+H2O?S2-+H3O+ | ||
| C. | CO32-+2H2O?H2CO3+2OH- | D. | F-+H2O═HF+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
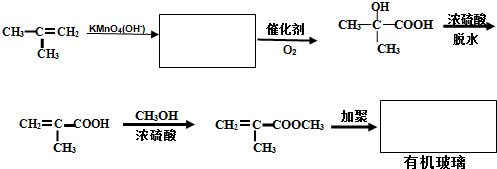
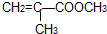 不溶于水,并可以发生以下变化:
不溶于水,并可以发生以下变化: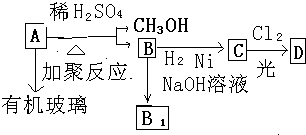
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水与氯化铵的pH=7的混合溶液中:[Cl-]>[NH4+] | |
| B. | pH=2的CH3COOH和pH=12的NaOH等体积混合,[OH-]=[H+] | |
| C. | 0.1 mol•L-1的硫酸铵溶液中:[NH4+]+[H+]=2[SO42-]+[OH-] | |
| D. | 0.1 mol•L-1的硫化钠溶液中:[H+]+[Na+]=[OH-]+[HS-]+[S2-] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PE、PVC都属于高分子化合物 | |
| B. | 质量相同的乙烯和聚乙烯完全燃烧耗氧量相同 | |
| C. | 乙烯和氯乙烯都是不饱和烃,二者都能使溴水褪色,而PE、PVC不能使溴水褪色 | |
| D. | 回收利用废弃的PE和PVC可减少白色污染,焚烧PVC 保鲜膜会放出有毒气体如HCI |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com