
【化学—选修2化学与技术】(15分)
氯化亚铜(CuCl)是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化成绿色碱式盐。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下:
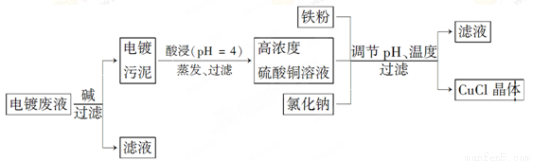
金属离子含量与混合液pH、CuCl产率与混合液pH的关系图如图。

【已知:金属离子浓度为1 mol·L-1时,Fe(OH)3开始沉淀和沉淀完全的pH分别为1.4和3.0,Cu(OH)2开始沉淀和沉淀完全的pH分别为4.2和6.7】
请回答下列问题:
(1)酸浸时发生反应的离子方程式是________;析出CuCl晶体时的最佳pH在_______左右。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为________________。
(3)析出的CuCl晶体要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2 h、冷却密封包装。70℃真空干燥、密封包装的目的是_____________________________________。
(4)产品滤出时所得滤液的主要分成是________,若想从滤液中获取FeSO4·7H2O晶体,还需要知道的是__________________。
(5)若将铁粉换成亚硫酸钠也可得到氯化亚铜,试写出该反应的化学方程式:____________________。为提高CuCl的产率,常在该反应体系中加入稀碱溶液,调节pH至3.5。这样做的目的是_____________。
(1)Cu(OH)2+2H+=Cu2++2H2O(2分) ;3(1分) (2)2Cu2++2Cl-+Fe=2CuCl↓+Fe2+(2分)
(3)加快乙醇和水的蒸发,防止CuCl被空气氧化 (2分)
(4)Na2SO4和FeSO4 (2分) 不同温度下硫酸钠和硫酸亚铁的溶解度(2分)
(5)2CuSO4+ Na2SO3+2NaCl+ H2O=2CuCl↓+2 Na2SO4+ H2SO4(2分)
OH-中和了反应中的H+,有利于平衡向右移动,提高CuCl的产率。但当OH-浓度过大时,Cu+能与OH-结合,生成氢氧化亚铜,从而降低了CuCl的产率。(2分)
【解析】
试题分析:(1)加入碱液后铁离子和铜离子分别转化为氢氧化铜和氢氧化铁沉淀,由于酸浸时pH=4,而在pH=3时铁离子就已经完全沉淀,所以酸浸时主要是氢氧化铜溶解,发生反应的离子方程式是Cu(OH)2+2H+=Cu2++2H2O;根据图像可判断,氯化亚铜的产率最高时对应的pH值大约是3,所以析出CuCl晶体时的最佳pH在3左右。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl,根据原子守恒和元素化合价变化可知反应中还有硫酸亚铁和硫酸钠生成,则反应的离子反应方程式为2Cu2++2Cl-+Fe=2CuCl↓+Fe2+。
(3)由于氯化亚铜微溶于水,不溶于乙醇,在空气中会被迅速氧化成绿色碱式盐,所以70℃真空干燥、密封包装的目的是加快乙醇和水的蒸发,防止CuCl被空气氧化。
(4)根据(2)中分析可知产品滤出时所得滤液的主要分成是Na2SO4和FeSO4。由于硫酸钠和硫酸亚铁均是溶于水水的,所以若想从滤液中获取FeSO4·7H2O晶体,还需要知道的是不同温度下硫酸钠和硫酸亚铁的溶解度。
(5)若将铁粉换成亚硫酸钠也可得到氯化亚铜,则亚硫酸钠被还原为硫酸钠,该反应的化学方程式为2CuSO4+ Na2SO3+2NaCl+ H2O=2CuCl↓+2 Na2SO4+ H2SO4。在该反应体系中加入稀碱溶液,中和了反应中的H+,有利于平衡向右移动,提高CuCl的产率。但又因为当OH-浓度过大时,Cu+能与OH-结合,生成氢氧化亚铜,从而降低了CuCl的产率,所以需要调节pH至3.5。
考点:考查物质制备实验方案设计与探究


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源:2014-2015学年四川省德阳市四校高三3月联合考试理综化学试卷(解析版) 题型:选择题
在25℃时,下列溶液的pH或微粒的物质的量浓度关系正确的是
A.将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,则充分反应后的混合液:2c(OH-)=2c(H+)+c(HA)-c(A-)
B.某溶液中存在的离子有S2-、HS-、OH-、Na+、H+,则离子浓度的大小关系一定是:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
C.将pH=4的醋酸溶液与pH=10的KOH溶液等体积混合,则充分反应后的混合液:c(CH3COO-)>c(H+)>c(K+)>c(OH-)
D.某物质的溶液中由水电离出c(H+)=1×10-amol/L,若a>7时,则该溶液的pH一定为14-a
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省德州市高三2月期末统考化学试卷(解析版) 题型:选择题
下列各组离子在指定的溶液中能大量共存的是
A.强酸性溶液中:Na+、Fe2+、Cl-、ClO-
B.加入Al能放出的H2溶液中:Cl-、HCO3-、NO3-、NH4+
C.在由水电离出的c(OH-)=10-13mol·L-1的溶液中:Fe2+、Al3+、NO3-、Cl-
D.pH=11的溶液中:CO32-、Na+、[Al(OH)4]-、NO3-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市姜堰区高三下学期期初联考化学试卷(解析版) 题型:选择题
室温下,将1mol的CuSO45H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2,CuSO45H2O受热分解的化学方程式为:CuSO45H2O(s)  CuSO4(s)+5H2O(l),热效应为△H3。则下列判断正确的是
CuSO4(s)+5H2O(l),热效应为△H3。则下列判断正确的是
A.△H2>△H3 B.△H1<△H3 C.△H1+△H3=△H2 D.△H1+△H2>△H3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市姜堰区高三下学期期初联考化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.使苯酚显紫色的溶液:NH4+、K+、SCN-、SO42-
B.使甲基橙变红色的溶液:Mg2+、K+、SO42- 、NO3-
C.由水电离的c(OH-)=10-13mol·L-1的溶液中:Na+、Cl-、CO32-、NO3-
D.c(Fe2+)=1.0 mol·L-1溶液:H+、K+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省仙桃天门潜江高三上学期期末联考理综化学试卷(解析版) 题型:填空题
【化学——选修3物质结构与性质】(15分)原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。
请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为 。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是 (填化学式),呈现如此递变规律的原因是 。
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为 ,另一种的晶胞如图二所示,该晶胞的空间利用率为 (保留两位有效数字)。( )
)

(4)D元素形成的单质,其晶体的堆积模型为 ,D的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是 (填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到的现象是 。请写出上述过程的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省八市高三年级三月联考理综化学试卷(解析版) 题型:选择题
仅用下表提供的仪器和药品,就能达到相应实验目的是
编号 | 仪器 | 药品 | 实验目的 |
A | 托盘天平(带砝码)、胶头滴管、量筒、烧杯、药匙、玻璃棒 | NaCl固体、蒸馏水 | 配制一定质量分 数的NaCl溶液 |
B | 分液漏斗、烧瓶、锥形瓶、 导管及橡皮塞 | 盐酸、大理石、硅酸钠溶液 | 证明非金属性: Cl>C>Si |
C | 酸式滴定管、胶头滴管、铁架台(带铁夹) | 已知浓度的盐酸、 待测NaOH溶液 | 测定NaOH溶液 的物质的量浓度 |
D | 烧杯、分液漏斗、胶头滴管、铁架台 | 待提纯的A1C13溶液、NaOH溶液 | 提纯混有MgC12 杂质的AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省肇庆市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列事实不能证明醋酸是弱酸的是
A.醋酸钠溶液的pH>7 B.常温下,0.1 mol·L-1醋酸溶液pH=2.5
C.醋酸能使紫色石蕊试液变红 D.pH=3的醋酸溶液稀释100倍后pH<5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com