
| A. | Ba(OH)2.8H2O与NH4Cl反应 | B. | 钠与冷水的反应 | ||
| C. | 灼热的炭与CO2反应 | D. | 甲烷与O2的燃烧反应 |
分析 常见的吸热反应有:Ba(OH)2.8H2O与NH4Cl反应、大多数分解反应、有碳参加的氧化还原反应等;在化学反应中有元素化合价变化的反应属于氧化还原反应,以此来解答.
解答 解:A.Ba(OH)2.8H2O与NH4Cl反应为吸热反应,但该反应中各元素的化合价没有发生变化,故A不选;
B.钠与冷水的反应为放热反应,且该反应中Na元素的化合价升高,H元素的化合价降低,属于氧化还原反应,故B不选;
C.灼热的炭与CO2反应为吸热反应,且该反应中碳元素的化合价发生变化,则属于氧化还原反应,故C选;
D.甲烷与O2的燃烧反应为放热反应,且该反应中C元素的化合价升高,O元素的化合价降低,属于氧化还原反应,故D不选;
故选C.
点评 本题考查常见的吸热反应与放热反应及氧化还原反应,学生应注重归纳常见的吸热反应,并熟悉发生的化学反应中是否存在元素的化合价变化来解答即可,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | c(OH-)=2.0×10-7mol•L-1 | B. | Kw=1×10-14 | ||
| C. | c(OH-)=1.0×10-14/2.0×10-7mol•L-1 | D. | 温度为25℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (2)(4)(5) | B. | (2)(7) | C. | (1)(3)(4) | D. | (5)(6)(7) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯、苯、环己烷属于脂肪烃 | B. | 苯、环己烷属于芳香烃 | ||
| C. | 乙烯、乙炔属于烯烃 | D. | 环戊烷、环己烷属于环烷烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的金属性比Y的金属性弱 | |
| B. | 常温下,X和Y都不能从水中置换出氢 | |
| C. | Y元素的氢氧化物碱性比X元素的氢氧化物碱性小 | |
| D. | X元素的最高化合价比Y 元素的最高化合价低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取21.82g食盐 | |
| B. | 用酸式滴定管量取15.30mL 0.10mol/L H2SO4溶液 | |
| C. | 用量筒量取13.56mL盐酸 | |
| D. | 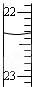 滴定达终点时,右图滴定管的正确读数为23.65mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2NH3(g)△H=-92kJ•mol-1.
2NH3(g)△H=-92kJ•mol-1.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com