
����Ŀ�������ס��غųƷ��ϵġ���Ҫ�ء�����ѧ���ϵ�ʩ�ã�ʹũҵ�������գ�����Ч�����������ǻ�ѧ���ϵ���ʩ����Ҳ�Ի��������������Ӱ�졣��������֪ʶ����Ϣ�ش��������⣺
��1����ͼ��ijƷ�ƻ��ʰ�װ���еIJ�������

��д����Ϊԭ����ȡ�û��ʵĸ�����ѧ����ʽ_______��
�ڹ��ڸõ��ʵĴ��ú�ʩ����ȷ�ķ�����_______��
A�����ľ�һ��ʩ��
B�������飬���������û�
C�����þ�ʻ��ʩ��
D���ھ����Ź�ˮ�ĵ�����ʩ�÷�Ч���
�����û��ʵ������в�����Ԫ�أ���û��ʵĴ�����_______��
��2���ס��ҡ����������ʳ������������õ�ԭ�ϲ�ͬ��������������ͬ��
![]()
�ټ׳��Խ�̿��ˮΪԭ�ϣ����ҳ�����Ȼ����ˮΪԭ�ϣ��۱�����ʯ���ͣ���Ҫ�ɷ�ΪC5H12����ˮΪԭ�ϡ�����ҵ�йع涨������ԭ�����Ƶõ�ԭ����H2��CO2�����ʵ���֮�ȣ�����ӽ��ϳ����ص�ԭ����NH3�������H2�����ʵ�������CO2�����ʵ���֮�ȣ����ԭ�ϵ���������ߡ��ݴ��жϼס��ҡ������������ĸ�������ԭ�ϵ���������ߣ�_______��
��3����������ˮ�����͡��ೱ��ʱ�з�������ר�ҷ���������ˮ�帻Ӫ������ɵģ��Է���ˮ�帻Ӫ������ԭ��_______��
���𰸡�4NH3+5O2![]() 4NO+6H2O��2NO+O2��2NO2��3NO2+H2O��2HNO3+NO��NH3+HNO3��NH4NO3C98%����N��P���ʵĴ���ʩ���Լ�������ˮ�Ĵ����ŷţ�����������ˮ������ʩ���ؽ�����ˮ�帻Ӫ��������������ˮ���������ೱ��
4NO+6H2O��2NO+O2��2NO2��3NO2+H2O��2HNO3+NO��NH3+HNO3��NH4NO3C98%����N��P���ʵĴ���ʩ���Լ�������ˮ�Ĵ����ŷţ�����������ˮ������ʩ���ؽ�����ˮ�帻Ӫ��������������ˮ���������ೱ��
��������
��1���ٰ�������������NO��NO��������Ӧ����NO2��NO2��ˮ��Ӧ�������ᣬ����Ͱ�����Ӧ��������泥���ѧ����ʽΪ4NH3+5O2![]() 4NO+6H2O��2NO+O2��2NO2��3NO2+H2O��2HNO3+NO��NH3+HNO3��NH4NO3��
4NO+6H2O��2NO+O2��2NO2��3NO2+H2O��2HNO3+NO��NH3+HNO3��NH4NO3��
��A����ľ���к���̼��أ�ˮ���Լ��ԣ�笠�ˮ�������ԣ��̬���ʲ������ľ�һ��ʹ�ã��������NH3�ݳ���A����
B��NH4NO3��飬����������������ը��B����
C���õ��������þ�ʻ��ʩ�ã�C��ȷ��
D����NH4NO3��ˮ��Ϊһˮ�ϰ�������N����ʧ��D����
��ѡC��
�۸û��ʵ������в�����Ԫ�أ�NH4NO3�ĺ�����Ϊ35%����Ϊ![]() 98%��
98%��
��2���ס��ҡ�������Ҫ��Ӧ�ֱ�ΪC+H2O��g��![]() CO+H2��CH4+H2O
CO+H2��CH4+H2O![]() CO+3H2��C5H12+5H2O
CO+3H2��C5H12+5H2O![]() 5CO+11H2����������COת��CO2���䷴ӦʽCO+H2O
5CO+11H2����������COת��CO2���䷴ӦʽCO+H2O![]() CO2+H2���ʼס��ҡ�������H2��CO2�����ʵ�����Ϊ���ף�2��1���ң�4��1������16��5�����ϳ����ص�H2��CO2�����ʵ�����Ϊ3��1 ʱ����˱���������ߣ�
CO2+H2���ʼס��ҡ�������H2��CO2�����ʵ�����Ϊ���ף�2��1���ң�4��1������16��5�����ϳ����ص�H2��CO2�����ʵ�����Ϊ3��1 ʱ����˱���������ߣ�
��3���������и��ֺ��������л���ķ���ˮ����ˮ�У���ʹˮ��Ӫ��������������ˮ���������ೱ����


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Һ�к�Ba2+����Һ�У����ܴ������ڵ������ǣ� ��
A.OH��
B.HCO3��
C.Cl��
D.SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����H��C��N��O��S��Ԫ���γɶ��ֻ�����������������������ҪӦ�á�
I.�����������ü����ˮ������Ӧ�õ���CO��H2Ϊ���Ļ�����壬���ֻ����������������״����ش���������:
��1���Լ�����ԣ�������������Ҫ��Ӧ:
��CH4(g)+1/2O2(g)=CO(g)+2H2(g)��H1=-36kJ��mol-1
2CH4(g)+H2O(g)=CO(g)+3H2(g)��H2=+216kJ��mol-1
��������������ɢ������ת���ʾ�Ϊ100%������¯�г���������ֻ��CO��H2��Ϊά����ƽ�⣬������lmolCO,ת�Ƶ��ӵ���ĿΪ______________________��
��2���״���������Ƶ���Ҫ�Ļ�����Ʒһ��ȩ���Ʊ�������������ת����ϵ��ͼ��ʾ��
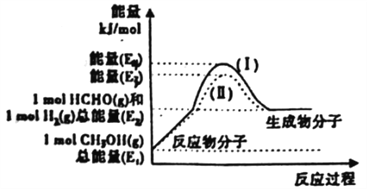
��д��������Ӧ���Ȼ�ѧ����ʽ________________________________��
�ڷ�Ӧ�ȴ�С�Ƚ�:����I________����II(��������������С��������������)��
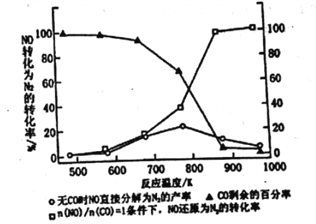
II.��3������ʹ���Ҵ����Ͳ����ܼ���NOx���ŷţ���ʹNOx����Ч������Ϊ������ǵ���Ҫ���⡣ij�о���С����ʵ������Ag-ZSM-5Ϊ������ɾ��NOת��ΪN2��ת�������¶ȱ仯�����ͼ��ʾ������ʹ��CO���¶ȳ���775K������NO�ķֽ��ʽ��͡�����ܵ�ԭ��Ϊ_____________________________________��
��n(NO)/n(CO)=1�������£�Ϊ���õij�ȥNOx���ʣ�Ӧ���Ƶ�����¶���_______K���ҡ�
��4�������ŷŵĵ������úȼ�ղ����Ķ��������ǵ������������������������������̿�ɴ���������Ⱦ��NO����5L�ܱ������м���NO�ͻ���̿(����������)��һ����������������E��F�����¶ȷֱ���T1����T2��ʱ����ø�����ƽ��ʱ���ʵ���(n/mol)���±�:
���� �¶��� | ����̿ | NO | E | F |
��ʼ | 3.000 | 0.10 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
��д��NO�����̿��Ӧ�Ļ�ѧ����ʽ_________________________________________��
����T1<T2
��������ӦT1��ʱ�ﵽ��ѧƽ�����ͨ��0.1mol NO���壬��ﵽ�»�ѧƽ��ʱNO��ת����Ϊ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ�����(POCl3)��һ����Ҫ�Ļ���ԭ�ϣ��������뵼����Ӽ���ʵ������ȡPOCl3���ⶨ��Ʒ������ʵ���������:
I.�Ʊ�POCl3������������Һ̬��PCl3����ʵ��װ��(���ȼ��г�װ��ʡ�ԡ��������Ϣ���¡�
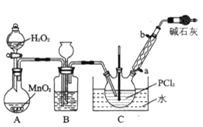
���� | �۵�/�� | �е�/�� | ��Է������� | ���� |
PCl3 | �D112.0 | 76.0 | 137.5 | ��Ϊ��ɫҺ�壬��ˮ������ ˮ��Ϊ��������Ȼ��⣬������ |
POCl3 | 2.0 | 106.0 | 153.5 |
��1������a������Ϊ_______________________________��
��2��װ��C������POCl3�Ļ�ѧ����ʽΪ________________________________��
��3��ʵ���������ͨ��O2�����ʣ��Դ˲�ȡ�IJ�����_________________________________��
��4��װ��B�����ó��۲�O2������֮�⣬����___________________________________��
��5����Ӧ�¶�Ӧ������60~65����ԭ����__________________________________��
II.�ⶨPOCl3��Ʒ������ʵ�鲽�裺
��ʵ��I������������ƿ��Һ����ȴ�����£�ȷ��ȡ16.725g POCl3��Ʒ������ʢ��60.00 mL����ˮ��ˮ��ƿ��ҡ������ȫˮ�⣬��ˮ��Һ���100.00mL��Һ
��ȡ10.00mL��Һ����ƿ�У�����10.00mL 3.5mol/L AgNO3����Һ��Ag++Cl-=AgCl����
�ۼ����������������������ܶȱ�ˮ����������ˮ��
������������ҺΪָʾ������0.2mol/L KSCN��Һ�ζ�������AgNO3��Һ��Ag++SCN-=AgSCN�����������յ�ʱ����ȥ10.00mL KSCN��Һ��
��6���ﵽ�յ�ʱ��������_________________________________________��
��7����ò�Ʒ��n(POCl3)= ___________________________��
��8����֪Ksp(AgCl)> Ksp(AgSCN)���ݴ��жϣ���ȡ������ۣ��ζ������_______������ƫ�ߣ�ƫ�ͣ��䣩
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ȳ���������M�Ľṹ��ʽ��M��ϡ���������µ�ˮ�ⷴӦ��ͼ��ʾ�������й�˵������ȷ���� (����)
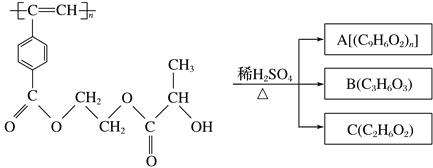
M
A. M��A����ʹ���Ը��������Һ����ˮ��ɫ
B. B�к����Ȼ����ǻ����ֹ����ţ��ܷ�����ȥ��Ӧ��������Ӧ
C. 1 mol M���ȵ��ռ���Һ��Ӧ��������2n mol NaOH
D. A��B��C��1 mol�ֱ�������Ʒ�Ӧ���ų���������ʵ���֮��Ϊ1��2��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�ɢϵ���ܷ��������������ǣ� ��
A.����B.������������C.����ͭ��ҺD.�̡��ơ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ж���������ȼú�����в����Ķ��������������Լ��������������ɽ��������������Ҫ��ɡ���������ü�ޣ�����ǧ�
I.�ѵ�
��֪�� ��2CO(g)+O2(g)===2CO2(g) ��H1=-566.0 kJ��mol-1
��2NO(g)+O2===2NO2(g) ��H2=-116.5kJ��mol-1
��N2(g)+O2(g)===2NO(g) ��H3=+180.5kJ��mol-1
��1����ȼú�������ķ�����NO2 ��CO ת��������Ⱦ������Ȼ�ѧ����ʽΪ��________________________________��
��2����1molN2(g)1mo1O2(g)�����л�ѧ������ʱ�ֱ�����946kJ��498KJ����������1mo1NO(g) �����л�ѧ������ʱ��Ҫ���յ�����Ϊ_____________________KJ��
��.����ķ�Ӧԭ��2CO(g) +SO2(g)![]() 2CO2(g) +S(1) ��H=-QkJ��mol-1��Q>0��
2CO2(g) +S(1) ��H=-QkJ��mol-1��Q>0��
��1������һ���¶��£��������ʵ���Ϊ3 mol��CO(g)��SO2(g) �Բ�ͬ��������2 L�ĺ��������У������ͼ��ʾ��a��b�ֱ��ʾSO2��CO��ƽ��ת���ʵı仯��c��ʾƽ����ϵ��CO2����������ı仯��
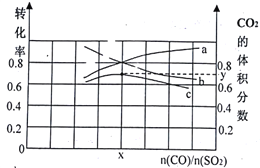
��ͼ����x=__________��CO2���������y=_________����ȷ��0.01�������¶��µ�ƽ�ⳣ��K=_____��
��2����T1���£���CO��SO2�������Ϊ5��4����һ��ѹ�ܱ������У���ʱ�������Ϊ0.1V L��
���������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬����_____________��
a.S(l)����������
b.K����
c.�����������ƽ����Է�����������
d.2v��(SO2)= v��(CO2)
e.Qֵ����
��ѹǿһ���������£��ڲ�ͬ�¶��½��з�Ӧ���������������仯��ͼ��ʾ��
��֪: n1��n2
�¶�(��) | ��ʼͶ������ | ��ʼͶ��v (CO) /v (SO2) | ��ʼ���(L) | ƽ�����(L) |
T1 | n1 | 5��4 | 0.1v | 0.07v |
T2 | n2 | 5��4 | 0.3v | 0.22v |
��T1�¶�ʱ��SO2��ƽ��ת����Ϊ_____%��
�Ƚϴ�С��T1___T2(�>������<������=��)������ԭ��____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�ӦX(g)��3Y(g)![]() 2Z(g)����X��Y��Z����ʼŨ�ȷֱ�Ϊc1��c2��c3(����Ϊ��)���ﵽƽ��ʱ��X��Y��ZŨ�ȷֱ�Ϊ0.1 mol��L��1��0.3 mol��L��1��0.08 mol��L��1���������жϲ���������(����)
2Z(g)����X��Y��Z����ʼŨ�ȷֱ�Ϊc1��c2��c3(����Ϊ��)���ﵽƽ��ʱ��X��Y��ZŨ�ȷֱ�Ϊ0.1 mol��L��1��0.3 mol��L��1��0.08 mol��L��1���������жϲ���������(����)
A. c1��c2��1��3
B. ƽ��ʱ��Y��Z����������֮��Ϊ2��3
C. X��Y��ת�������
D. c1��ȡֵ��ΧΪ0<c1<0.14 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��д��ȷ����
A. ��������ˮ��Ӧ��Na+H2O��Na++OH-+H2��
B. NaHCO3��ˮ�ⷴӦ��HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
C. ����ϡHNO3��Ӧ����ҺpH��1��3Fe+8H++2NO3-��3Fe2++2NO��+4H2O
D. ��Mg(HCO3)2��Һ�м������NaOH��Һ��Mg2++2HCO3-+4OH-��Mg(OH)2��+2CO32-+2H2O
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com