
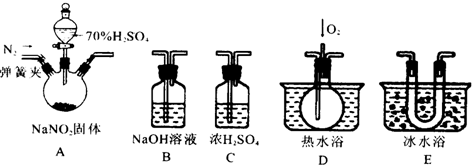
���� ������NaNO2�Ļ�ѧ����Ϊ���壬̽���������ƺ�ϡ���ᷴӦ��������ijɷ֣��ѵ�����NO2�Ĵ��ڶ�NO�ļ����и��ţ��ʼ���NO2��Ҫ�ų�NO2�����ټ���NO���ر�ע�����NO2���뷴Ӧ����NO�����������Ҫ������ǵ���������Ի�������Ⱦ������Ҫ��NaOH��Һ���ս���β���������ݴ˷������⣻
��1�����ݸ�����װ�õ����ý������ӣ�
��2������һ��������������Ӧ���ɺ���ɫ�������������жϣ��¶ȵ��ڶ�������Һ���¶�ʱ�������������Һ̬��
��3����������������B�п�����Ϊ���������ᣬ���������������Ʒ�Ӧ���������ƺ�ˮ��
��4�����ݷ�Ӧ���������д����Ӧ����ʽ��
��5�����ݸ�˹���ɽ��м��㣮
��� �⣺��1��C����ˮ������Bβ����������ֹ��Ⱦ������D����NO��E��ȴ��������������D����NO������װ�õ�����ΪA��C��E��D��B����װ���������������еIJ���ʵ���Ǽ��װ�������ԣ�
�ʴ�Ϊ��E��D��B�� ���װ�������ԣ�
��2����D����ɫ�����ɺ�ɫ��˵������NO���壬�ʴ�Ϊ��D�г��ֺ���ɫ���壻
�ڶ���������Һ���¶���21�棬���ڴ��¶�ʱ����������������Һ̬���ʴ�Ϊ������ʹNO2��ȫҺ����
��3�������D��ͨ�����O2����װ��B�ж����������������������Ʒ�Ӧ���������ƺ�ˮ���䷴Ӧ����ʽΪ��4NO2+O2+4NaOH=4NaNO3+2H2O�����û��װ��C������������ˮ��Ӧ����һ����������ɸ��ţ�
�ʴ�Ϊ��4NO2+O2+4NaOH=4NaNO3+2H2O��ˮ�������ڣ�����NO2��Ӧ����NO��Ӱ��NO�ļ��飻
��4��ͨ�����Ϸ���֪���÷�Ӧ�����ɶ���������һ��������ͬʱ���������ơ�ˮ���ɣ����Է�Ӧ����ʽΪ2NaNO2+H2SO4=Na2SO4+NO2��+NO��+H2O��
�ʴ�Ϊ��2NaNO2+H2SO4=Na2SO4+NO2��+NO��+H2O��
��5����֪����CH4��g��+2NO2��g���TN2��g��+CO2��g��+2H2O��g����H=-867kJ•mol-1
��2CH4��g��+4NO��g���T2N2��g��+CO2��g��+2H2O��g����H=-1160kJ•mol-1
��CH4��NO2��ԭΪNO�ķ�ӦCH4��g��+4NO2��g��=4NO��g��+CO2��g��+2H2O��g�������Ǣ١�2-�ڵõ������ԡ�H=2����-867kJ•mol-1��+1160kJ•mol-1=-574kJ•mol-1��
�ʴ�Ϊ��CH4��g��+4NO2��g��=4NO��g��+CO2��g��+2H2O��g����H=-574kJ•mol-1��
���� ���⿼����ʵ�鷽����ơ����ʵļ��顢��˹���ɣ���ȷ���ʵ������ǽⱾ��ؼ�������ʵ������ȷ�����ʵ����ʣ�ע������������˳��Ϊ�״��㣬��Ŀ�Ѷ��еȣ�


 Сѧ�̲���ȫ���ϵ�д�
Сѧ�̲���ȫ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 22.4LCO��CO2�Ļ��������������̼ԭ����һ����NA | |
| B�� | ��״���£�22.4L�������ԭ����Ϊ2Na | |
| C�� | ���³�ѹ�£�32g O2��O3�����������ԭ������2NA | |
| D�� | ���ʵ���Ũ��Ϊ0.5mol/L MgCl2��Һ������Cl-������Ϊ1NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ϊʹ�������ʼӿ죬���ò������ڹ�������������裬����Һ������ | |
| B�� | �þƾ��Ƹ��Թܼ���ʱ��Ҫ�������ȵ��Թܷ��ھƾ��ƻ���������� | |
| C�� | Ϊ���ٹ������ʵ��ܽ�ֻ�ܲ��ü��ȵķ��� | |
| D�� | Ϊ�����������ʵ��ܽ�ȣ�����ȡ���衢���ȵȴ�ʩ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �÷�Ӧ�����û���Ӧ | B�� | I2���л�ԭ�� | ||
| C�� | ������1mol Cl2ʱת��2mol���� | D�� | ��������KClO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | S��s��+O2��g���TSO2��g������H1 S��g��+O2��g���TSO2��g������H2 | |
| B�� | 2H2��g��+O2��g���T2H2O��g������H1 2H2��g��+O2��g���T2H2O��l������H2 | |
| C�� | CO��g��+$\frac{1}{2}$O2��g���TCO2��g������H1 2CO��g��+O2��g���T2CO2��g������H2 | |
| D�� | H2 ��g��+Cl2��g���T2HCl��g������H1 $\frac{1}{2}$H2��g��+$\frac{1}{2}$Cl2��g���THCl��g������H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ����ɵ��ʶ���Ԫ�ص�ԭ�ӽṹ��ͼΪ
����ɵ��ʶ���Ԫ�ص�ԭ�ӽṹ��ͼΪ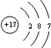 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���³�ѹ�£�1mol�������еĺ��������Ϊ4NA | |
| B�� | 0.25mol Na2O2�к��е���������Ϊ0.5NA | |
| C�� | 50ml 18.4mol/LŨ����������ͭ�ȣ���������0.46NA | |
| D�� | 25��ʱ��7g C2H4��C3H6�Ļ�������У�����NA��C-H�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com