
| X | A | ||
| Y | C | B |
| A. | 元素原子半径大小顺序为:A<B<C<Y | |
| B. | 最高价含氧酸的酸性强弱顺序为:H2YO3<H2XO3 | |
| C. | A、B两种元素气态氢化物的沸点高低顺序为:HA<HB | |
| D. | B、C简单离子的还原性强弱顺序为:B-<C2- |
分析 A是电负性最大的元素,则A是F元素,根据元素在周期表中的位置知,X是C元素、Y是Si元素、C是S元素、B是Cl元素.
A.同周期自左而右原子半径减小,同主族自上而下原子半径增大;
B.同主族自上而下元素非金属性减弱,元素的非金属性越强,其最高价氧化物的水化物的酸性越强;
C.HF分子之间存在氢键大沸点高于HCl;
D.元素的非金属性越强,其简单阴离子的还原性越弱.
解答 解:A是电负性最大的元素,则A是F元素,根据元素在周期表中的位置知,X是C元素、Y是Si元素、C是S元素、B是Cl元素.
A.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:A<B<C<Y,故A正确;
B.C元素的非金属性大于Si元素,则X、Y最高价氧化物对应的水化物的酸性由弱到强的顺序为:H2SiO3<H2CO3,故B正确;
C.HF分子之间存在氢键大,HCl分子之间为范德华力,氢键比较范德华力更强,故HF沸点高于HCl,故C错误;
D.Cl的非金属性大于S,所以简单阴离子的还原性Cl-<S 2-,故D正确;
故选:C.
点评 本题考查了元素周期表和元素周期律的综合应用,正确判断元素是解本题关键,注意对元素周期律的理解,注意氢键对物质性质的影响.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:填空题
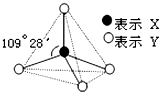 甲、乙、丙、丁、戊具有如图所示的结构或结构单元,图中四面体外可能有的部分未画出,只有实线表示共价键,X、Y可同可不同.
甲、乙、丙、丁、戊具有如图所示的结构或结构单元,图中四面体外可能有的部分未画出,只有实线表示共价键,X、Y可同可不同.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组用图一所示装置进行探究实验.以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.
某化学兴趣小组用图一所示装置进行探究实验.以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO42-═BaS04↓+2H2O | |
| B. | 酸性介质中KMnO4氧化 H2O2:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O | |
| C. | 等物质的量的MgCl2、Ba(OH)2 和 HCl 溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| D. | 铅酸蓄电池充电时的正极反应:PbSO4+2H2O-2e-═PbO2+4H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将2mol/L NaAlO2溶液和3mol/L的HCl溶液等体积互相均匀混合:6AlO2-+9H++3H2O═5Al(OH)3↓+Al3+ | |
| B. | 向1mol/L明矾溶液50mL中滴入数滴0.1mol/L Ba(OH)2溶液:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| D. | NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+═2Mn2++5NO3-+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 该烃系统命名为:3-甲基-1,3-戊二烯
该烃系统命名为:3-甲基-1,3-戊二烯 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com