



 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
| A、用苯萃取溴水中的Br2时,有机层从分液漏斗的下端放出 |
| B、检验溶液中是否含有SO42-,依次滴入Ba(NO3)2溶液和稀盐酸 |
| C、配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出 |
| D、配制AlCl3溶液时,将AlCl3溶解在较浓的盐酸中,再用水稀释到所需浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
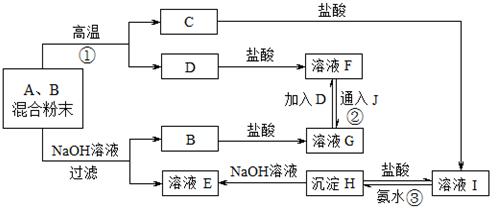
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
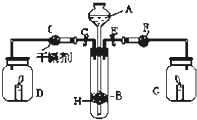 为证明有关物质的性质,某学生设计了如图所示的装置.当打开活塞C,使液体A与隔板H上的固体B相遇时,即有气体产生,并发现D中蜡烛熄灭;关闭C 打开E时,则看到G中蜡烛燃得更亮,且F中盛放固体为淡黄色.
为证明有关物质的性质,某学生设计了如图所示的装置.当打开活塞C,使液体A与隔板H上的固体B相遇时,即有气体产生,并发现D中蜡烛熄灭;关闭C 打开E时,则看到G中蜡烛燃得更亮,且F中盛放固体为淡黄色.查看答案和解析>>
科目:高中化学 来源: 题型:
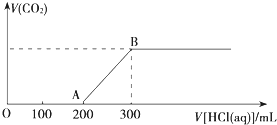 向100mL 3mol?L-1的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7.
向100mL 3mol?L-1的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.3g金属钠变为钠离子时失去的电子数是0.1NA |
| B、0.5NA个氯分子所占体积约为11.2L |
| C、28g氮气所含原子数为2NA |
| D、18g水所含的质子总数为10NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com