
科目:高中化学 来源: 题型:
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca===CaCl2+Li2SO4+Pb。
下列有关说法正确的是( )
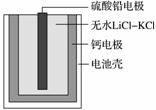
A.正极反应式:Ca+2Cl--2e-===CaCl2
B.放电过程中,Li+向负极移动
C.每转移0.1 mol电子,理论上生成20.7 g Pb
D.常温时,在正负极间接上电流表或检流计,指针不偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
实验:①0.1 mol·L-1AgNO3溶液和0.1 mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;
②向滤液b中滴加0.1 mol·L-1KI溶液,出现浑浊;
③向沉淀c中滴加0.1 mol·L-1KI溶液,沉淀变为黄色。
下列分析不正确的是( )
A.浊液a中存在沉淀溶解平衡:AgCl(s)Ag+(aq)+Cl-(aq)
B.滤液b中不含有Ag+
C.③中颜色变化说明AgCl转化为AgI
D.实验可以证明AgI比AgCl更难溶
查看答案和解析>>
科目:高中化学 来源: 题型:
锶(38Sr)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与20Ca和56Ba同属于第ⅡA族。
(1)碱性:Sr(OH)2____Ba(OH)2(填“>”或“<”);锶的化学性质与钙和钡类似,用原子结构的观点解释其原因是______________。
(2)碳酸锶是最重要的锶化合物。用含SrSO4和少量BaSO4、BaCO3、FeO、Fe2O3、Al2O3、SiO2的天青石制备SrCO3,工艺流程如下(部分操作和条件略):
Ⅰ.将天青石矿粉和Na2CO3溶液充分混合,过滤;
Ⅱ.将滤渣溶于盐酸,过滤;
Ⅲ.向Ⅱ所得滤液中加入浓硫酸,过滤;
Ⅳ.向Ⅲ所得滤液中先加入次氯酸,充分反应后再用氨水调pH约为7,过滤;
Ⅴ.向Ⅳ所得滤液中加入稍过量NH4HCO3,充分反应后,过滤,将沉淀洗净,烘干,得到SrCO3。
已知:ⅰ.相同温度时的溶解度:BaSO4<SrCO3<SrSO4<CaSO4
ⅱ.生成氢氧化物沉淀的pH
| 物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀pH | 1.9 | 7.0 | 3.4 |
| 完全沉淀pH | 3.2 | 9.0 | 4.7 |
①Ⅰ中,反应的化学方程式是__________________________________________________。
②Ⅱ中,能与盐酸反应溶解的物质有___________________________________________。
③Ⅳ的目的是__________________________________________。
④下列关于该工艺流程的说法正确的是________(填字母)。
a.该工艺产生的废液含较多的NH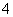 、Na+、Cl-、SO
、Na+、Cl-、SO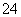
b.Ⅴ中反应时,升高温度一定可以提高SrCO3的生成速率
c.Ⅴ中反应时,加入溶液一定可以提高NH4HCO3的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
由第一电离能数据推断,最有可能生成稳定的单核阳离子的元素是( )
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
A. 氟 B.氯 C.溴 D.碘
查看答案和解析>>
科目:高中化学 来源: 题型:
| 审题指导 | |||||||||||||
| TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。 (1)实验室利用反应TiO2(s)+CCl4(g) 有关物质性质如下表:
仪器A的名称是________。装置E中的试剂是________。 反应开始前依次进行如下操作: 组装仪器、________、加装药品、通N2一段时间后点燃酒精灯。反应结束后的操作包括:①停止通N2 ②熄灭酒精灯 ③冷却至室温。正确的顺序为________(填序号)。欲分离D 中的液态混合物,所采用操作的名称是________。 | 题干信息:反应条件是无水无氧,因而要先排空气,且要保 持反应装置内干燥。 装置图信息:A的作用是干燥氮气,B处产生CCl4(g),C为核心反应装置,D为冷凝装置,E为干燥装置,防止空气中的 水蒸气进入。 表格信息:根据CCl4和TiCl4的沸点可知在冰水中都会液 化,分离可用蒸馏。 问题信息:回答操作顺序,联系题干信息和装置特点知,N2必须进行干燥处理(干燥管);然后通过N2排除系统内的空气(O2),点燃酒精灯,使反应发生;为了防止倒吸,反应结束后,应先熄灭酒精灯。 | ||||||||||||
| (2)工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2 的有关反应包括: 酸溶 FeTiO3(s)+2H2SO4(aq)===FeSO4(aq)+TiOSO4(aq)+ 2H2O(l) 水解 TiOSO4(aq)+2H2O(l) 简要工艺流程如下:
①试剂A为________。钛液Ⅰ需冷却至70 ℃左右,若温度 过高会导致产品TiO2回收率降低,原因是________________________________________________________________________________________________________________________________________________。 ②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是________。这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是______________(填化学式)。 | |||||||||||||
| 题干信息:Fe2O3杂质可溶于硫酸;FeTiO3酸溶后的产物TiOSO4易水解。 流程图信息:试剂A的作用是将溶液中的Fe3+转化为Fe2+ 问题信息:①解释TiO2的回收率,联系题干信息,从水解的视角。 ②Fe2+的检验方法;含Fe2+的溶液蒸干后变为Fe2O3。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
对于可逆反应A(g)+3B(s)2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是( )
A.v(A)=0.5 mol·L-1·min-1
B.v(B)=1.2 mol·L-1·s-1
C.v(D)=0.4 mol·L-1·min-1
D.v(C)=0.1 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
在Na2CO3中加醋酸产生CO2气体,试从电离平衡常数的角度解释原因[已知:K(CH3COOH)=1.7×10-5;K(H2CO3)=4.3×10-7。]:_____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com