
| J | ||||
| R |
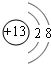 ;元素T在周期表中位于第ⅦA族,故答案为:
;元素T在周期表中位于第ⅦA族,故答案为: ;ⅦA;
;ⅦA;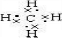 ,故答案为:
,故答案为: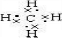 ;
;

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 催化剂 |
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、放电时,LixC6发生氧化反应 |
| B、充电时,Li+通过阳离子交换膜从左向右移动 |
| C、充电时将电池的负极与外接电源的负极相连 |
| D、放电时,电池的正极反应为Li1-xCoO2+xLi++xe-═LiCoO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
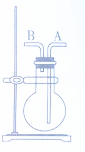 利用右图所示装置收集或干燥以下三种气体.(图中烧瓶的位置不得变化)利用如图所示装置收集以下3种气体(图中烧瓶位置不得移动)
利用右图所示装置收集或干燥以下三种气体.(图中烧瓶的位置不得变化)利用如图所示装置收集以下3种气体(图中烧瓶位置不得移动)查看答案和解析>>
科目:高中化学 来源: 题型:
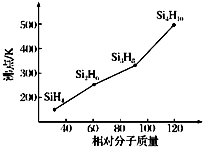 太阳能电池的发展已经进入了第三代.第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGS(CIS中掺入Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池.
太阳能电池的发展已经进入了第三代.第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGS(CIS中掺入Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com