
【题目】关于氢键,下列说法正确的是( )
A. 每一个水分子内含有两个氢键
B. 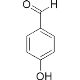 的熔沸点明显高于
的熔沸点明显高于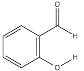 ,对羟基苯甲醛分子间存在氢键,而邻羟基苯甲醛存在分子内氢键。
,对羟基苯甲醛分子间存在氢键,而邻羟基苯甲醛存在分子内氢键。
C. H2O是一种非常稳定的化合物,这是由于氢键所致
D. SO2易溶于水,重要的原因之一是由于SO2与H2O之间能形成氢键
科目:高中化学 来源: 题型:
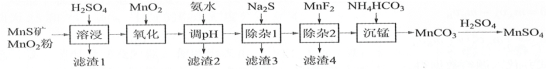
【题目】 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式_______。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是______
(6)写出“沉锰”的离子方程式_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为保持街道整洁、湿润,在路面或广场上喷洒含化学式为XY2的溶液作保湿剂。X原子的结构示意图为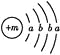 ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
(1)m= ,该保湿剂的化学式为
(2)Z、W元素的名称为 、
(3)下列说法中正确的是
A.XY2和WZ2都为离子化合物
B.XY2中仅含离子键,WZ2中仅含极性共价键
C.H2Z比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是
A.XY2的电子式:X2+![]()
B.WZ2的结构式:Z=W=Z
C.Y元素的单质与H2Z水溶液反应的离子方程式为:Y2+Z2-2Y-+Z↓
D.用电子式表示XY2的形成过程为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中所含微粒的个数比是1∶1的是( )
A. CH3COONa溶液中CH3COO-和Na+
B. NH4+中的质子和电子
C. Na2O2固体中阴、阳离子
D. ![]() 原子中的质子和中子
原子中的质子和中子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A.加入催化剂可以加快合成氨的速率
B.新制的氯水在光照条件下颜色变浅
C.实验室中常用排饱和食盐水的方法收集氯气
D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关图像,其中说法正确的是

A. 由图Ⅰ知,反应在 T1、T3 处达到平衡
B. 由图Ⅰ知,该反应的△H<0
C. 由图Ⅱ知,t3时采取降低反应温度的措施
D. 由图Ⅱ知,反应在 t6时,NH3 体积分数最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
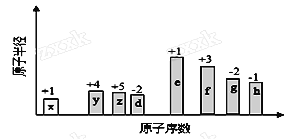
根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________。
(2)比较d、e常见离子的半径的大小(用化学式表示,下同)_______>__________;比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______>__________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________。
(4)已知1mole的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非物质文化遗产“芜湖铁画”的某些产品中含有铁、金和碳等成分(其他成分忽略不计)。某同学取一定质量的铁画废弃样品,加入100mL稀盐酸中,恰好完全反应,放出0.3gH2,剩余固体质量为0.1g。请计算:
(1)样品中铁的质量分数。
(2)稀盐酸的物质的量浓度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2 L密闭容器中充入4 mol A气体和3 mol B气体,发生下列反应:2A(g)+B(g)![]() C(g)+xD(g),5 s达到平衡。达到平衡时,生成了1 mol C,测定D的浓度为1 mol·L-1。
C(g)+xD(g),5 s达到平衡。达到平衡时,生成了1 mol C,测定D的浓度为1 mol·L-1。
(1)求x=_____。
(2)求这段时间A的平均反应速率为_____。
(3)平衡时A的转化率为_____。
(4)下列叙述能说明上述反应达到平衡状态的是_____
A. 单位时间内每消耗2 mol A,同时生成1 mol C
B. 单位时间内每生成1 molB,同时生成1 molC
C. D的体积分数不再变化
D. 混合气体的压强不再变化
E. B、C 的浓度之比为1:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com