



 ÓäæģµÄŗ®¼ŁÄĻ¾©³ö°ęÉēĻµĮŠ“š°ø
ÓäæģµÄŗ®¼ŁÄĻ¾©³ö°ęÉēĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| A”¢ÓĆŹ³“×æÉŅŌ³żČČĖ®ĘæÄŚµÄĖ®¹ø |
| B”¢“×ĖįČÜŅŗÓĆĖ®Ļ”ŹĶŗóĒāĄė×ÓÅضČĻĀ½µ |
| C”¢pH=2µÄ“×ĖįČÜŅŗĻ”ŹĶ1000±¶ŗópHŠ”ÓŚ5 |
| D”¢ÓĆÅØH2SO4ŗĶ“×ĖįÄĘ¹ĢĢå¹²ČČæÉÖʵƓ×Ėį |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
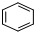 ÖĘČ”
ÖĘČ”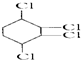 £¬
£¬
 £¬Ōņ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ
£¬Ōņ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
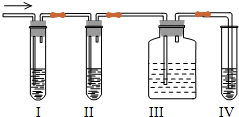
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
 ij½šŹōMµÄĻą¶ŌŌ×ÓÖŹĮæĪŖ112.4£®ĖüµÄĀČ»ÆĪļ»ÆѧŹ½ĪŖMClx£®ÓŠa gĀČ»ÆĪļČÜÓŚĖ®£¬ÖĘ³É0.2mol?L-1µÄČÜŅŗ1L£®ÓƶčŠŌµē¼«µē½ā£¬A²ŪµÄŅõ¼«ŌöÖŲ0.0539g£¬B²ŪµÄŅõ¼«ŌöÖŲ0.0281g£®Ēó£ŗ
ij½šŹōMµÄĻą¶ŌŌ×ÓÖŹĮæĪŖ112.4£®ĖüµÄĀČ»ÆĪļ»ÆѧŹ½ĪŖMClx£®ÓŠa gĀČ»ÆĪļČÜÓŚĖ®£¬ÖĘ³É0.2mol?L-1µÄČÜŅŗ1L£®ÓƶčŠŌµē¼«µē½ā£¬A²ŪµÄŅõ¼«ŌöÖŲ0.0539g£¬B²ŪµÄŅõ¼«ŌöÖŲ0.0281g£®Ēó£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
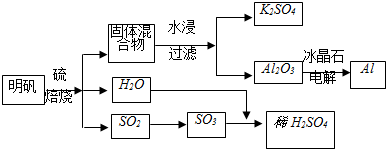
| ||
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| A”¢¶žŃõ»Æ¹č¾§ĢåµÄ·Ö×ÓŹ½ĪŖ£ŗSiO2 | ||||
B”¢CO2µÄµē×ÓŹ½ĪŖ£ŗ | ||||
C”¢Ąė×Ó½į¹¹Ź¾ŅāĶ¼ĪŖ£ŗ µÄĪ¢Ąū¼ČæɱķŹ¾ µÄĪ¢Ąū¼ČæɱķŹ¾
| ||||
| D”¢“ĪĀČĖįµÄ½į¹¹Ź½ĪŖ£ŗH-Cl-O |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| ±»Ģį“æµÄĪļÖŹ | ³żŌÓŹŌ¼Į | ·ÖĄė·½·Ø | |
| A | ŅŅĖįŅŅõ„£ØŅŅĖį£© | CCl4 | ŻĶČ””¢·ÖŅŗ |
| B | ŅŅĶé£ØŅŅĻ©£© | øßĆĢĖį¼ŲČÜŅŗ | Ļ“Ęų |
| C | ŅŅ“¼£ØŅŅĖį£© | ŠĀÖĘŃõ»ÆøĘ | ÕōĮó |
| D | ±½£Øä壩 | µā»Æ¼ŲČÜŅŗ | ·ÖŅŗ |
| AӢA | BӢB | CӢC | DӢD |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| A”¢ŅŅĻ©ŗĶ±½¶¼ÄÜŹ¹äåĖ®ĶŹÉ«£¬¹Ź²»ÄÜÓĆäåĖ®¼ų±šŅŅĻ©ŗĶ±½ÕōĘų |
| B”¢HNO3ÄÜÓė±½”¢¼×±½”¢øŹÓĶ”¢ĻĖĪ¬ĖŲµČÓŠ»śĪļ·¢ÉśÖŲŅŖ·“Ó¦£¬³£ÓĆÅØĮņĖį×÷“߻ƼĮ |
| C”¢½öÓĆŠĀÖʵÄĒāŃõ»ÆĶŠü×ĒŅŗŅ»ÖÖŹŌ¼Į²»æɼų±šŅŅ“¼”¢ŅŅČ©”¢ŅŅĖį”¢ŅŅĖįŅŅõ„ |
| D”¢±½ÓėĖįŠŌKMnO4ČÜŅŗ»ģŗĻÕńµ“”¢¾²ÖĆ·Ö²ć£¬ĻĀ²ćŅŗĢåĪŖĪŽÉ« |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com