
����Ŀ���о�������NOx��SO2����������Ҫ�ɷ֡�
��NOx��Ҫ��Դ������β����
��֪��N2��g����O2��g��![]() 2NO��g�� ��H����180.50 kJ��mol��1
2NO��g�� ��H����180.50 kJ��mol��1
2CO��g����O2��g��![]() 2 CO2��g�� ��H����566.00kJ��mol��1
2 CO2��g�� ��H����566.00kJ��mol��1
��1��Ϊ�˼��������Ⱦ���������������β�������ܿڲ��ô�����NO��COת��������Ⱦ����������ѭ����д���÷�Ӧ���Ȼ�ѧ����ʽ_________________��
��2��T��ʱ���������ʵ�����NO��CO�����ݻ�Ϊ2L���ܱ������У������¶Ⱥ�������䣬��Ӧ���̣�0��15min����NO�����ʵ�����ʱ��仯�Ĺ�ϵ����ͼ��ʾ��
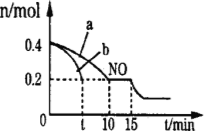
��T��ʱ�û�ѧ��Ӧ��ƽ�ⳣ��K��_______________��ƽ��ʱ�������¶Ȳ��䣬���������г���CO��N2��0.8mol��ƽ�⽫_______�ƶ���������������ҡ�����
��ͼ��a��b�ֱ��ʾ��һ���¶��£�ʹ��������ͬ���������ͬ�Ĵ���ʱ���ﵽƽ�������n(NO)�ı仯���ߣ����б�ʾ����������ϴ��������__________���a����b������
��15minʱ�����ı���練Ӧ����������n(NO)������ͼ��ʾ�ı仯����ı������������_______��
����SO2��Ҫ��Դ��ú��ȼ�ա�ȼú��������������Ǽ��ٴ����к�������Ⱦ�Ĺؼ���
��3���ô�����Һ����SO2�ɽ���ת��ΪHSO3�����÷�Ӧ�����ӷ���ʽ��___________________��
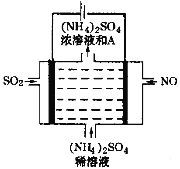
��4����ͼ���װ�ÿɽ������е�NO��SO2�ֱ�ת��ΪNH4+��SO42��������A�Ļ�ѧʽΪ_____________�������ĵ缫��Ӧʽ��________________________��
���𰸡���1��2NO��g��+2CO��g��![]() 2CO2��g��+N2��g����H=��746.50kJ��mol��1
2CO2��g��+N2��g����H=��746.50kJ��mol��1
��2����5mol/L-1�����ң�2�֣�����b��������CO�����ʵ���Ũ�ȣ�������ѹǿ�������¶ȵ���
��3��H2O+2SO2+CO32-=2HSO3-+CO2����2����
��4��H2SO4��1�֣���NO+6H++5e��=NH4++H2O��2�֣�
��������
�����������1����֪��N2(g)+O2(g)![]() 2NO(g)��H=+180.50kJmol-1��
2NO(g)��H=+180.50kJmol-1��
2CO(g)+O2(g)![]() CO2(g)��H=-566.00kJmol-1��
CO2(g)��H=-566.00kJmol-1��
���ݸ�˹���ɣ���-�ٵõ���2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)��H=-746.50 kJmol-1��
2CO2(g)+N2(g)��H=-746.50 kJmol-1��
��2������ʼʱ��NOΪ0.4mol��ƽ��ʱNOΪ0.2mol��
2NO(g)+2CO(g)![]() 2CO2(g)+N2
2CO2(g)+N2
��ʼ����0.4mol 0.4mol 0 0
ת������0.2mol 0.2mol 0.2mol 0.1mol
ƽ������0.2mol 0.2mol 0.2mol 0.1mol
��ƽ��ʱ��Ũ�ȣ�c(NO)=0.1mol/L��c(CO)=0.1mol/L��c(CO2)=0.1mol/L��c(N2)=0.05mol/L
k��![]() ��5(mol/L)-1��
��5(mol/L)-1��
ƽ��ʱ�������¶Ȳ��䣬���������г���CO��N2��0.8mol��
��c(CO)=0.5mol/L��c(N2)=0.45mol/L��
Qc��![]() ��1.8��k����ƽ�⽫�����ƶ���
��1.8��k����ƽ�⽫�����ƶ���
�ڴ���������ϴ�Ӧ���ʿ죬�ﵽƽ������ʱ��̣���ͼ��֪��b���ߴ����������·�Ӧ���ʿ죬����b�Ĵ����ı�����ʴ�Ϊb��
����ͼ���֪��NO��Ũ�ȼ�С��ƽ�����������ƶ������Ըı������Ϊ����CO�����ʵ���Ũ�Ȼ�����ѹǿ��
��3��̼������Һ��SO2��Ӧ�������������ƺͶ�����̼���䷴Ӧ�����ӷ���ʽΪ��H2O+2SO2+CO32-��2HSO3-+CO2����
��4�����װ�D�ɽ������е�NO��SO2�ֱ�ת��ΪNH4+��SO42-�����ⷽ��ʽΪ5SO2+2NO+8H2O![]() (NH4)2SO4+4H2SO4���ɵ�ⷽ��ʽ��֪������AΪ���ᣬ��Ļ�ѧʽH2SO4�����ʱ�������϶�������ʧ����������������ӣ�������NO�õ�����ת��Ϊ笠����������ĵ缫��Ӧʽ��NO + 6H+ + 5e��= NH4+ +H2O��
(NH4)2SO4+4H2SO4���ɵ�ⷽ��ʽ��֪������AΪ���ᣬ��Ļ�ѧʽH2SO4�����ʱ�������϶�������ʧ����������������ӣ�������NO�õ�����ת��Ϊ笠����������ĵ缫��Ӧʽ��NO + 6H+ + 5e��= NH4+ +H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦA(g)+3B(g)![]() 2C(g)+2D(g), �����ֲ�ͬ����µķ�Ӧ����, ���з�Ӧ����������( )
2C(g)+2D(g), �����ֲ�ͬ����µķ�Ӧ����, ���з�Ӧ����������( )
A��v(D)=24mol��L-1��min-1
B��v(C)=0.5mol��L-1��s-1
C��v(B)=30mol��L-1��min-1
D��v(A)=0.15mol��L-1��s-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
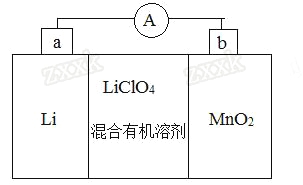
����Ŀ����2014��߿����Ͼ���16�⡿��̵�ص����С�������������dz��õ�һ�ε�ء��õ�ط�Ӧԭ����ͼ��ʾ�����е����LiCIO4�����ڻ���л��ܼ��У�Li+ͨ�������Ǩ����MnO2�����У�����LiMnO2��
�ش��������⣺
��4��MnO2����KOH��KClO3���ڸ����·�Ӧ������K2MnO4����Ӧ�Ļ�ѧ����ʽΪ_______________K2MnO4��������Һ���绯������KMnO4��MnO2�����ʵ���֮��Ϊ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£���3 mol A��1 mol B������������2L�����ܱ������У��������·�Ӧ��3A(g) + B(g)![]() xC(g)+2D(g)��2 minĩ�÷�Ӧ�ﵽƽ�⣬����0.8 mol D�������C��Ũ��Ϊ0.2 mol��L-l�������ж���ȷ���ǣ� ��
xC(g)+2D(g)��2 minĩ�÷�Ӧ�ﵽƽ�⣬����0.8 mol D�������C��Ũ��Ϊ0.2 mol��L-l�������ж���ȷ���ǣ� ��
A. A��ת����Ϊ40%
B. 2 min��B�ķ�Ӧ����Ϊ0.2 mol��L-l��min-1
C. x=2
D. �����������ܶȲ��䣬������÷�Ӧ�Ѵﵽƽ��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ����������������ȫȼ��ʱ����Ҫ�������ٵ��ǣ� ��
A.CH4
B.C2H4
C.C3H6
D.C2H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ӧ�У�ŨH2SO4�ȱ����������ԣ��ֱ��ֳ����Ե��ǣ�������
A. C+2H2SO4��Ũ��![]() CO2��+2SO2��+2H2O
CO2��+2SO2��+2H2O
B. Fe2O3+3H2SO4 = Fe2��SO4��3+3H2O
C. Na2CO3+H2SO4 = Na2SO4+CO2��+H2O
D. Cu+2H2SO4��Ũ��![]() CuSO4+SO2��+2H2O
CuSO4+SO2��+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���з�Ӧ��Ϊ���ȷ�Ӧ�����з�Ӧ����С����
A. 2A(l) + B(l) = 2C (g) ��H1
B. 2A(g) + B(g) = 2C(g) ��H2
C. 2A (g) + B ( g ) = 2C(l) ��H3
D. 2A (l) + B(l)= 2C(l) ��H4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ����H1=-393.5kJmol-1����H2=-395.4kJmol-1������˵����ȷ���ǣ� ��
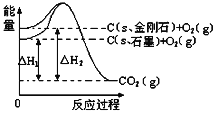
A. ʯīת��Ϊ���ʯ�Ƿ��ȷ�Ӧ
B. ʯī�ͽ��ʯ���ת���������仯
C. ���ʯ���ȶ���ǿ��ʯī
D. ��������ʯī����ʯ��ȫȼ�գ����ʯ�ų�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬ��ͬѹ�£���ͬ�����N2��CO2����������ֵΪ �����ʵ����ı�ֵ �� ԭ������֮��Ϊ �� ����֮��Ϊ �� �ܶ�֮��Ϊ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com