
已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12 mol3·L-3,Ksp[MgF2]=7.42×10-11 mol3·L-3。下列说法正确的是( )
A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的[Mg2+]大
B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,[Mg2+]增大
C.25℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL 0.01 mol·L-1 NH4Cl溶液中的Ksp小
D.25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后, Mg(OH)2不可能转化为MgF2
 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
下列关于碳和硅的叙述中,正确的是( )
A.其氧化物都能与NaOH溶液反应
B.其单质在加热时都能跟O2反应
C.其氧化物都能溶于水生成相应的酸
D.碳和硅两种 元素共有两种单质
元素共有两种单质
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.精炼铜时粗铜作阴极,纯铜作阳极
B.工业上利用电解饱和AlCl3溶液的方法生产金属铝
C.氯碱工业和金属钠的冶炼都用到了NaCl,阳极反应都是2Cl--2e-====Cl2↑
D.钢铁的腐蚀通常为电化学腐蚀,该腐蚀过程中负极反应为Fe-3e-====Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
在合成氨时,要使氨的产率增大,又要使化学反应速率增大,可以采取的措施有( )
①增大体积使压强减小 ②减小体积使压强增大 ③升高温度 ④降低温度 ⑤恒温恒容,再充入等量的N2和H2
⑥恒温恒压,再充入等量的N2和H2 ⑦及时分离产生的NH3 ⑧使用正催化剂
A.②④⑤⑦ B.②③④⑤⑦⑧ C.②⑤ D.②③⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
下表的实验数据是在不同温度和压强下,平衡混合物中NH3含量的变化情况。达到平衡时平衡混合物中NH3的含量(体积分数)[入料V(N2)∶V(H2)=1∶3]
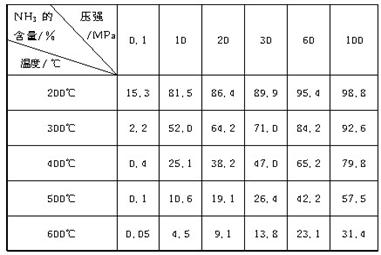
(1)比较200℃和300℃时的数据,可判断升高温度,平衡向____________方向移动,正反应方向为________(填“吸热”或“放热”)反应。
(2)根据平衡移动原理,合成氨适宜的条件是________。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(3)计算500℃,30 MPa时N2的转化率________。
(4)实际工业生产合成氨时,考虑浓度对化学平衡的影响,还采取了一些措施。请写出其中的一个措施:________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:某温度时,Ksp(AgCl)=1.8×10-10 mol2·L-2,Ksp(Ag2CrO4)=1.1×10-12 mol3·L-3。
试求:
(1)此温度下AgCl饱和溶液和Ag2CrO4饱和溶液的物质的量浓度,并比较两者的大小。
(2)此温度下,在0.010 mol·L-1的AgNO3溶液中,AgCl与Ag2CrO4分别能达到的最大物质的量浓度,并比较两者的大小。
查看答案和解析>>
科目:高中化学 来源: 题型:
金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )
A.阳极发生还原反应,其电极反应式:Ni2++2e-—→Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
查看答案和解析>>
科目:高中化学 来源: 题型:
对于常温下pH=3的乙酸溶液,下列说法正确的是双选) )。
A.cH+)=cCH3COO-)+cOH-)
B.加水稀释到原体积的10倍后溶液pH变为4
C.加入少量乙酸钠固体,溶液pH升高
D.与等体积pH为11的NaOH溶液混合后所得溶液中:cNa+)=cCH3COO-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com