
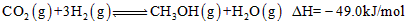 ,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。 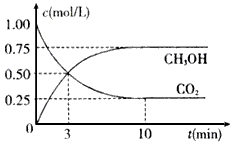
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
(12分)为减弱温室效应,除了减少CO2的排放、植树造林、将液态CO2注入深海等措施外,还有一种思路是将CO2转化成其它可燃物质。如工业上已实现CO2和H2反应生成甲醇的转化。已知:在一恒温、恒容密闭容器中充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) =CH3OH (g)+H2O(g) △H= -49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。请回答:
(1)达到平衡的时刻是____________min(填“3”或“10”)。在前10min内,用CO2表示的反应速率![]() (CO2)=________
(CO2)=________
(2)能判断该反应达到化学平衡状态的依据是 。
a.容器压强不变 b.混合气体中c(CO2)不变
c.![]() (CH3OH)=
(CH3OH)= ![]() (H2O) d.c(CH3OH)=c(H2O)
(H2O) d.c(CH3OH)=c(H2O)
(3)为了提高H2的转化率,可采取__________(填“增大”或“减小”)CO2浓度的措施。
(4)达平衡后,H2的转化率是_____________。平衡常数K=____________。(计算结果保留一位小数)
查看答案和解析>>
科目:高中化学 来源:2011-2012学年湖南省衡阳八中高二第二次月考化学试卷 题型:填空题
(12分)为减弱温室效应,除了减少CO2的排放、植树造林、将液态CO2注入深海等措施外,还有一种思路是将CO2转化成其它可燃物质。如工业上已实现CO2和H2反应生成甲醇的转化。已知:在一恒温、恒容密闭容器中充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) =CH3OH(g)+H2O(g)


 △H= -49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。请回答
△H= -49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。请回答 :
:
(1)达到平衡的时刻是____________min(填“3”或“10”)。 在前10min内,用CO2表示的反应速率
在前10min内,用CO2表示的反应速率 (CO2)="________"
(CO2)="________"
(2)能判断该反应达到化学平衡状态的依据是 。 a.容器压强不变 b.混合气体中c(CO2)不变
a.容器压强不变 b.混合气体中c(CO2)不变
c. (CH3OH)=
(CH3OH)=  (H2O) d.c(CH3
(H2O) d.c(CH3 OH)=c(H2O)
OH)=c(H2O) (3)为了提高H2的转化率,可采取__________(填“增大”或“减小”)CO2浓度的措施。
(3)为了提高H2的转化率,可采取__________(填“增大”或“减小”)CO2浓度的措施。
(4)达平衡后,H2的转化率是_____________。平衡常数K=____________。(计算结果保留一位小数)
查看答案和解析>>
科目:高中化学 来源:2013届湖南省高二第二次月考化学试卷 题型:填空题
(12分)
为减弱温室效应,除了减少CO2的排放、植树造林、将液态CO2注入深海等措施外,还有一种思路是将CO2转化成其它可燃物质。如工业上已实现CO2和H2反应生成甲醇的转化。已知:在一恒温、恒容密闭容器中充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) =CH3OH (g)+H2O(g)
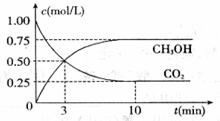
 △H= -49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。请回答:
△H= -49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。请回答:
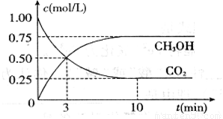
(1)达到平衡的时刻是____________min(填“3”或“10”)。 在前10min内,用CO2表示的反应速率
在前10min内,用CO2表示的反应速率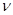 (CO2)=________
(CO2)=________
(2)能判断该反应达到化学平衡状态的依据是 。
a.容器压强不变 b.混合气体中c(CO2)不变
c.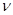 (CH3OH)=
(CH3OH)= 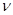 (H2O)
d.c(CH3OH)=c(H2O)
(H2O)
d.c(CH3OH)=c(H2O)
 (3)为了提高H2的转化率,可采取__________(填“增大”或“减小”)CO2浓度的措施。
(3)为了提高H2的转化率,可采取__________(填“增大”或“减小”)CO2浓度的措施。
(4)达平衡后,H2的转化率是_____________。平衡常数K=____________。(计算结果保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
为减弱温室效应,除了减少CO2的排放、植树造林、将液态CO2注入深海等措施外,还有一种思路是将CO2转化成其它可燃物质。如工业上已实现CO2和H2反应生成甲醇的转化。已知:在一恒温、恒容密闭容器中充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) =CH3OH (g)+H2O(g)![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() △H= -49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
△H= -49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。![]() 请回答
请回答![]()
![]() :
:
(1)达到平衡的时刻是____________min(填“3”或“10”)。
![]() 在前10min内,用CO2表示的反应速率
在前10min内,用CO2表示的反应速率![]() (CO2)=________
(CO2)=________
![]() (2)能判断该反应达到化学平衡状态的依据是 。
(2)能判断该反应达到化学平衡状态的依据是 。
![]() a.容器压强不变 b.混合气体中c(CO2)不变
a.容器压强不变 b.混合气体中c(CO2)不变
![]() c.
c.![]() (CH3OH)=
(CH3OH)= ![]() (H2O) d.c(CH3OH)=c(H2O)
(H2O) d.c(CH3OH)=c(H2O)
![]() (3)为了提高H2的转化率,可采取__________(填“增大”或“减小”)CO2浓度的措施。
(3)为了提高H2的转化率,可采取__________(填“增大”或“减小”)CO2浓度的措施。
(4)达平衡后,H2的转化率是_____________。平衡常数K=____________。(计算结果保留一位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com