
分析 (1)求出硫酸钠的物质的量,然后根据物质的量浓度C=$\frac{n}{V}$来计算;
(2)溶液是均一稳定的,浓度与所取溶液的体积无关;由于取出的体积是原体积的四分之一,故所含溶质的质量是原溶液的四分之一;
(3)求出混合溶液中硫酸根的物质的量,然后根据物质的量浓度C=$\frac{n}{V}$来计算.
解答 解:(1)14.2g硫酸钠的物质的量为n=$\frac{m}{M}$=$\frac{14.2g}{142g/mol}$=0.1mol,故所配溶液的物质的量浓度C=$\frac{n}{V}$=$\frac{0.1mol}{0.2L}$=0.5mol/L,故答案为:0.5;
(2)溶液是均一稳定的,浓度与所取溶液的体积无关,故取出50mL溶液中,溶质的物质的量浓度仍为0.5mol/L;由于取出的体积是原体积的四分之一,故所含溶质的质量是原溶液的四分之一,故取出的50mL溶液中含有的硫酸钠的质量为$\frac{14.2g}{4}$=3.55g,故答案为:0.5;3.55;
(3)将50mL0.5mol/L的硫酸钠溶液和50mL0.2mol•L-1硫酸钾溶液混合后,所得混合溶液中硫酸根的物质的量n=0.5mol/L×0.05L+0.2mol/L×0.05L=0.035mol,故溶液中硫酸根的物质的量浓度C=$\frac{n}{V}$=$\frac{0.035mol}{0.1L}$=0.35mol/L,故答案为:0.35.
点评 本题考查了物质的量浓度的相关计算,熟练掌握公式的灵活运用和物质的结构特点是解题的关键所在,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
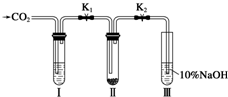 某课题研究小组的同学在查阅资料时得知,Na2O2与干燥的CO2不能发生反应,当有少量水存在时,Na2O2可与CO2发生反应生成Na2CO3和O2.为了探究“二氧化碳是否在有水存在时才能与过氧化钠反应”.某课题研究小组的同学们设计了如图所示的实验装置,分别进行甲、乙两次实验:
某课题研究小组的同学在查阅资料时得知,Na2O2与干燥的CO2不能发生反应,当有少量水存在时,Na2O2可与CO2发生反应生成Na2CO3和O2.为了探究“二氧化碳是否在有水存在时才能与过氧化钠反应”.某课题研究小组的同学们设计了如图所示的实验装置,分别进行甲、乙两次实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ③④⑤ | C. | ③④⑥ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L四氯化碳所含分子数为0.5 NA | |
| B. | 1mol/L的盐酸溶液中,所含氯化氢分子数为NA | |
| C. | 80g硝酸铵含有氮原予数为2NA | |
| D. | 1mol氯气和铁反应时转移的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑ | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH- | |
| C. | 在铁的表面镀上一层锌,铁作阳极,电极反应式为:Zn2++2e-=Zn | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在某钠盐溶液中含有等物质的量的Cl-、I-、AlO2-、CO32-、NO3-、SiO32-中若干种,当加入过量的盐酸产生气泡,溶液颜色变深,则原溶液中一定有CO32- | |
| B. | 如果某化学反应的△H和△S均小于0,则反应一定能自发进行 | |
| C. | 适量的Cl2通入FeI2溶液中可发生反应:3Cl2+6FeI2=2FeCl3+4FeI2 | |
| D. | 一定量氯气通入30mL 10mol•L-1的氢氧化钠溶液中,加热后形成NaCl、NaClO、NaClO3共存的溶液,若反应中转移的电子为n mol,则0.15<n<0.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | HCN为V形分子 | |
| B. | NO3-的空间构型为三角锥形 | |
| C. | SF6中有6对完全相同的成键电子对 | |
| D. | SO42-和SO32-的中心原子均为sp3杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
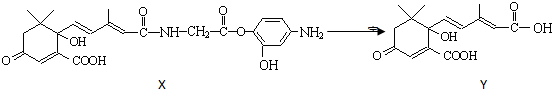 ( )
( )| A. | Y既可以与FeCl3溶液发生显色反应,又可使酸性KMnO4溶液褪色 | |
| B. | 1 molY与足量NaOH溶液反应,最多消耗3 mol NaOH | |
| C. | 1 molX最多能加成9 molH2 | |
| D. | X可以发生氧化、取代、酯化、加聚、缩聚反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com