
分析 (1)该反应中Mn元素化合价由+4价变为+2价、Cl元素化合价由-1价变为0价,转移电子数为2;
(2)得电子化合价降低的元素被还原,失电子化合价升高的元素被氧化;
(3)该反应中氧化剂是二氧化锰、有一半的HCl作还原剂;
(4)反应Mn元素化合价由+4价降低到+2价.
解答 解:(1)该反应中Mn元素化合价由+4价变为+2价、Cl元素化合价由-1价变为0价,转移电子数为2,则转移电子方向和数目为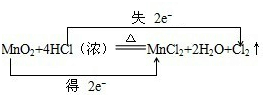 ,故答案为:
,故答案为: ;
;
(2)得电子化合价降低的元素被还原,失电子化合价升高的元素被氧化,该反应中Mn元素化合价由+4价变为+2价、MnO2为氧化剂,Cl元素化合价由-1价变为0价,所以Mn元素被还原、Cl元素被氧化,Cl2为氧化产物,故答案为:MnO2;Cl2;
(3)该反应中氧化剂是二氧化锰、有一半的HCl作还原剂,所以氧化剂和还原剂的物质的量之比为1:2,故答案为:1:2;
(4)反应Mn元素化合价由+4价降低到+2价,则有0.5mol MnO2完全反应,转移的电子的物质的量是1mol,故答案为:1.
点评 本题考查氧化还原反应计算,为高频考点,侧重考查基本概念、基本计算,明确元素化合价变化与概念之间关系是解本题关键,注意:该反应中有一半盐酸作还原剂,一半盐酸体现酸性.


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:解答题
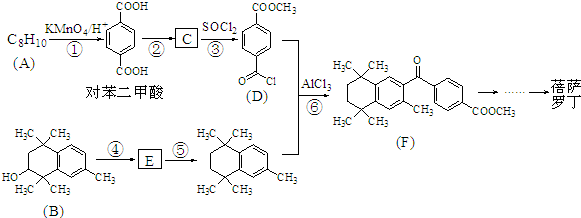
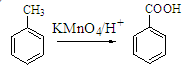 Ⅱ.
Ⅱ.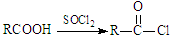
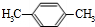 ,C的结构简式为
,C的结构简式为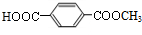 .
. ;⑤
;⑤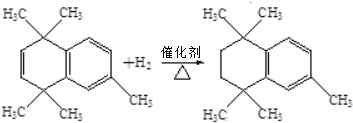 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
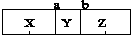 ),下列说法中错误的是( )
),下列说法中错误的是( )| A. | 若Y是C4H8,则X可能是N2 | B. | 分子数目:X=Z=2Y | ||
| C. | 若X是O2,则Z不可能是CO2 | D. | 气体密度:X=Z=2Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6:3:2 | B. | 3:2:1 | C. | 1:2:3 | D. | 1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25 mL 0.2mol/L的NaCl溶液 | B. | 100mL 0.1 mol/L的NaCl溶液 | ||
| C. | 25 mL 0.2 mol/L的Na2SO4溶液 | D. | 10 mL 0.5 mol/L的Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
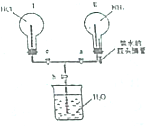 某实验小组在实验室中制取氨气并设计实验验证氨气的某些性质.
某实验小组在实验室中制取氨气并设计实验验证氨气的某些性质.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaNO2溶液的pH大于7 | B. | 用HNO2溶液作导电试验,灯泡很暗 | ||
| C. | HNO2不跟NaCl反应 | D. | 可以使石蕊试剂变色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com