
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:实验题
| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 22.7g | 18.6g |
查看答案和解析>>
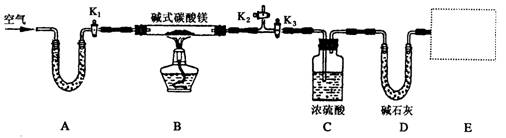
科目:高中化学 来源:不详 题型:实验题

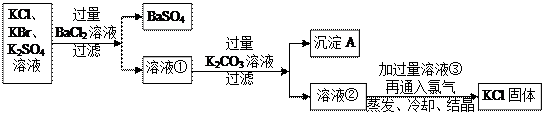
查看答案和解析>>
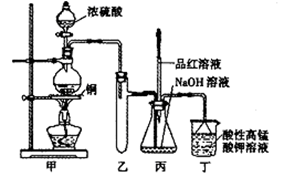
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
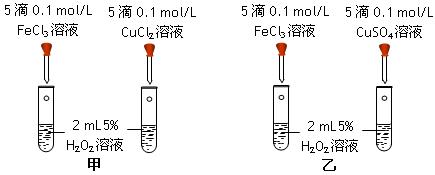
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
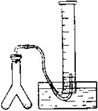
科目:高中化学 来源:不详 题型:实验题
| (1) 草酸晶体 | 分子式 | H2C2O4·2H2O | 颜色 | 无色晶体 |
| 熔点 | 100.1℃ | 受热至100.1℃时失去结晶水,成为无水草酸。 | ||
| (2) 无水草酸 | 结构简式 | HOOC—COOH | 溶解性 | 能溶于水或乙醇 |
| 特性 | 大约在157℃升华(175℃以上发生分解)。 | |||
| 化学性质 | H2C2O4 + Ba(OH)2 =BaC2O4↓+ 2H2O | |||
| HOOC—COOH >175℃ CO2↑+CO↑+H2O↑ | ||||

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题




 +IBr →
+IBr → ②IBr+KI=I2+KBr ③I2+2S2O32-=2I-+S4O62-
②IBr+KI=I2+KBr ③I2+2S2O32-=2I-+S4O62-


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com