
【题目】下列生产生活中所采取的措施不能用化学反应速率解释的是
A.有些食物的标签上注明须冷藏B.在糕点制作过程中添加防腐剂
C.在轮胎制品中加入适量的炭黑D.燃煤发电时常用煤粉代替煤块
科目:高中化学 来源: 题型:
【题目】下列关于硅及其化合物的叙述错误的是
A.SiO2很稳定,与所有的酸都不反应B.水晶、玛瑙的主要成分都是SiO2
C.陶瓷、玻璃、水泥都是硅酸盐产品D.水玻璃是一种常用的矿物胶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组设计实验检验生铁与浓硫酸反应的产物。回答下列问题:
Ⅰ.设计如下方案,检验气体产物中的CO2、SO2和H2O。

(1)干燥管B中M的化学式是______________________;
(2)C装置的作用是_________________________________________________;
(3)能证明有二氧化碳生成的实验现象是_______________________________;
(4)待生铁与浓硫酸反应完毕后,检验烧瓶中的溶液含有Fe3+的试剂是:________________。
Ⅱ.该课题组同学认为生铁与浓硫酸反应可能有氢气生成。为了验证这一猜想,选择下列仪器和药品并结合上述装置,重新设计实验。
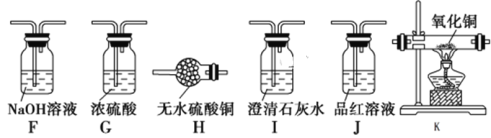
(5)根据实验设计的简约性原则,气流从左至右,仪器排序为______________。
(6)能证明有氢气生成的实验现象是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)利用反应CuSO4+Fe===Cu+FeSO4可设计为原电池。
(1)负极材料是________(写名称),电极反应为__________________________________。
(2)正极电极反应式为______________________。
(3)溶液中SO42-向________极移动。
(II)工业合成氨反应:N2+3H2![]() 2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。
2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。
(4)如果将1 mol N2和3 mol H2混合,使其充分反应,放出的热量总理论数值,其原因是____________________________。
(5)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,反应经过10 min后,生成10 mol NH3,则用N2表示的化学反应速率为________mol·L-1·min-1。
(6)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是________。
a.正反应速率和逆反应速率相等 b.正反应速率最大,逆反应速率为0
c.反应达到最大限度 d.N2和H2的浓度相等
e.生成1 mol N2的同时,消耗2 mol NH3 f.生成3 mol H2的同时,生成2 mol NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
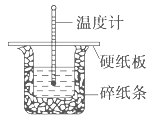
(1)从实验装置上看,图中尚缺少的一种玻璃用品是______________________。
(2)烧杯间填满碎纸条的作用是_________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值____________(填“偏大”“偏
小”“无影响” )。
(4)倒入NaOH溶液的正确操作是_________________________,使盐酸与NaOH溶液混合均匀的正确操作是___________________________。平行地做一次这样的实验需要测定_____次温度。
(5)三次平行操作测得的数据中,起始时盐酸与烧碱溶液温度相同,而终止温度与起始温度之差(t2-t1)分别为①2.3 ℃,②2.4 ℃,③2.9 ℃,则最终代入计算式的温度差的平均值为________ ℃。已知水的比热容为C为4.18J/(g·℃),稀盐酸和稀氢氧化钠溶液的密度别为ρ1、ρ2用量均为VmL,混合前溶液的平均温度为t1,混合溶液的最高温度为t2,则中和热ΔH=____________________ kJ/mol(请写出简化的代数式,否则不给分)。
(6)实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”“不相等”),所求中和热________(填“相等”“不相等”),用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会_______________。(填“偏大”“偏小”“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式与所述事实相符且正确的是
A. NaHS水解反应:HS-+H2O ![]() H3O++S2-
H3O++S2-
B. Fe(OH)2与稀硝酸反应:2H++Fe(OH)2=Fe2++2H2O
C. 过量的SO2通入到漂白粉溶液中:ClO-+SO2+H2O=HClO+HSO3-
D. Na2CO3水溶液中存在平衡:CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计方案一定可行的是( )
A.用水鉴别苯和四氯化碳
B.用降温结晶的方法除去KNO3中混有少量的NaCl
C.用分液的方法分离碘的四氯化碳溶液
D.用酒精萃取碘水中的碘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.1 mol·L-1、体积为V0的HA酸溶液和MOH碱溶液,分别加蒸馏水稀释,溶液pH随滴入的蒸馏水体积的变化曲线如图所示,下列叙述正确的是( )

A. HA为强酸,MOH为强碱
B. a点HA的电离度小于10%
C. 两种溶液无限稀释时,其c(H+)近似相等
D. 两种溶液稀释至V1时,b、c两点所示溶液中c(A-)>c(M+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值减小,可以采取的措施是
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值减小,可以采取的措施是
A. 通入少量HCl气体 B. 升高温度
C. 加少量醋酸钠晶体 D. 加水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com