
| NO | N2 | CO2 | |
| 起始浓度/mol•L-1 | 0.10 | 0 | 0 |
| 平衡浓度/mol•L-1 | 0.04 | 0.03 | 0.03 |
 ,再次达到平衡测得容器中NO、N2、CO2的浓度值比为5:3:3,则△H<0(填“>”、“=”或“<”).
,再次达到平衡测得容器中NO、N2、CO2的浓度值比为5:3:3,则△H<0(填“>”、“=”或“<”).分析 (1)③-①-②得2NO2(g)+CH4(g)=N2(g)+CO2(g)+2H2O(l),依据盖斯定律计算反应热,写出反应的热化学方程式;
(2)①依据化学平衡状态的实质是正逆反应速率相等,结合反应特征分析判断;
②依据图表数据分析,结合平衡浓度计算平衡常数和浓度变化分析判断;
(3)①电解池中发生氧化反应的一极为阳极,阳极与电源正极相连,依据装置图可知二氧化硫在左边失去电子发生氧化反应,据此判断;
②依据在碱性条件下,阴极排出的溶液为S2O42-,二氧化氮与其发生反应生成氮气和硫酸根离子,据此解答.
解答 解:(1)①N2(g)+O2(g)═2NO(g);△H1=180.5kJ•mol-1
②2NO(g)+O2(g)═2NO2(g);△H2=-113.0kJ•mol-1
③CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H3=-889.5kJ•mol-1
则:③-①-②得2NO2(g)+CH4(g)=N2(g)+CO2(g)+2H2O(l),依据盖斯定律得:△H=-957 kJ•mol-1;
故NO2与CH4转化成N2和H2O(l)的热化学方程式为:2NO2(g)+CH4(g)=N2(g)+CO2(g)+2H2O(l)△H=-957 kJ•mol-1;
故答案为:2NO2(g)+CH4(g)=N2(g)+CO2(g)+2H2O(l)△H=-957 kJ•mol-1;
(2)①a反应速率之比等于化学方程式系数之比,当v正(NO)=2v逆(N2),反应达到平衡,v正(NO)=2v正(N2)则:v正(NO)=v逆(NO)可以判断该反应达到平衡状态的标志,故正确;
b可逆反应达到平衡时,各种物质的浓度保持不变,N2的浓度保持不变可以判断该反应达到平衡状态的标志,故正确;
c反应是气体体积不变的反应,反应过程中和反应平衡状态压强相同,所以容器内压强保持不变不能说明反应达到平衡,故错误;
d容器内CO2的体积分数不变,说明反应达到平衡,故正确;
故选:abd;
②依据图中数据可知:改变条件前各物质浓度之比为4:3:3,若平衡后升高温度,再次达到平衡测得容器中NO、N2、CO2的浓度值比为5:3:3,则说明平衡向逆向移动,逆向为吸热反应,则正向为放热反应,故△H<0;
故答案为:<;
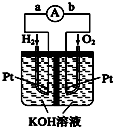
(3)①依据装置图可知二氧化硫在左边失去电子发生氧化反应生成硫酸根离子,电极反应式为:SO2+2H2O-2e-=SO42-+4H+,电解池中发生氧化反应的一极为阳极,阳极与电源正极相连,所以a为正极;
故答案为:正极;SO2+2H2O-2e-=SO42-+4H+;
②阴极排出的溶液为S2O42-,二氧化氮与其发生反应,S2O42-中硫元素由+3价,变为硫酸根中硫元素为+6价,S2O42-被氧化是还原剂;二氧化氮中的氮元素化合价为+4价变为氮气0价,二氧化氮被还原为氧化剂,发生的离子方程式为S2O42-+NO2+OH-→SO42-+N2+H2O,依据原子守恒和得失电子守恒可得S2O42-系数为2,NO2系数为3,所以该反应中氧化剂与还原剂的物质的量之比为3:2;
故答案为:3:2.
点评 本题为综合题,涉及反应热的计算、热化学方程式的书写,化学平衡状态的判断,化学平衡移动的影响因素,电解原理的分析应用等,题目难度中等,侧重于考查学生的分析能力和对基础知识的综合应用能力,掌握基础是解题关键.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:解答题
 在能源日趋紧张的今天,科学工作者一直在研究如何提高现有化石能源的利用率,同时寻找开发清洁可再生能源.常采用的方法有煤的气化、煤的液化、设计燃料电池等.
在能源日趋紧张的今天,科学工作者一直在研究如何提高现有化石能源的利用率,同时寻找开发清洁可再生能源.常采用的方法有煤的气化、煤的液化、设计燃料电池等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池工作时,锌失去电子,电解液内部OH-向负极移动 | |
| B. | 电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-═Mn2O3(s)+2OH-(aq) | |
| C. | 电池工作时,电子由正极通过外电路流向负极 | |
| D. | 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MOH能被醋酸中和 | |
| B. | 用MOH溶液做导电性实验,灯泡亮度较暗 | |
| C. | MOH可使酚酞试液变红 | |
| D. | 常温时0.1mol•L-1MOH溶液的pH约为11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成氨工业温度选择为700K左右,只要是为了提高NH3产率 | |
| B. | 使用催化剂和施加高压,都能提高反应速率,但对化学平衡状态无影响 | |
| C. | 合成氨生产过程中将NH3液化分离,可提高N2、H2的转化率 | |
| D. | 合成氨工业中为了提高氢气的利用率,可适当增加氢气浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 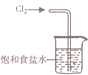 用装置吸收多余的氯气 | B. | 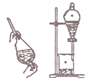 装置用酒精萃取分离水中的碘 | ||
| C. | 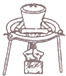 用装置除去纯碱中的小苏打 | D. |  用装置排水法收集氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释 |
| A | 铝箔在酒精灯上加热,溶化后的液态铝不滴落 | 高熔点的氧化铝薄膜兜在铝的外面,阻止了液态铝滴落 |
| B | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
| C | 铁放在冷浓硝酸中不溶解,无红棕色气体产生 | 铁遇浓硝酸钝化,表面形成致密的氧化膜,阻止内部铁继续与硝酸反应 |
| D | Na着火不能用水灭火 | Na遇水剧烈反应,易引发爆炸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com