
某工业废水里含游离氯0.04 mol•L-1,氢离子浓度为0.001 mol•L-1,废水排放速率10•s-1,为了变成无游离氯的中性水,在废水排出管的A、B处,分别注入0.1 mol•L-1 NaOH溶液和0.2 mol•L-1 Na2SO3溶液。
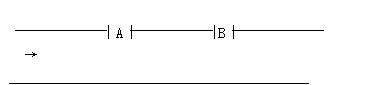
(1)在A、B处各应注入何种溶液?为什么?
(2)两种液体的流量应控制多大?
(1)A处:Na2SO3,B处:NaOH,因为加入Na2SO3,发生如下反应:Na2SO3+Cl2+H2O=Na2SO4+2HCl,可见除去Cl2又有H+产生,再加入NaOH中和才能得到无游离氯的中性水。 (2)Na2SO3流量0.7L · S-1,NaOH流量为2.9L·s-1。
|
(1)本题是利用氧化还原反应的原理对含有游离氯的废水进行处理,不但除去剩余Cl2,还要使水成为中性。因为Na2SO3与Cl2反应会产生H+,所以应先用Na2SO3,后用NaOH。 (2)设A处注入Na2SO3溶液流量为x L· s-1,B处注入NaOH溶液流量为y L· s-1,反应中产生H+的物质的量为z: Cl2 ~ Na2SO3 ~ 2H+ 1 1 2 0.014×10 0.2×x z 解得:x=0.7 L· s-1 , z=0.28 mol H+ ~ NaOH 1 1 0.28+0.001×10 0.1×y 解得:y=2.9L/S
|


科目:高中化学 来源:物理教研室 题型:022

(1)在A、B处各应注入何种溶液?为什么?
(2)两种液体的流量应控制多大?
查看答案和解析>>
科目:高中化学 来源: 题型:022
某工业废水里含游离氯0.04 mol•L-1,氢离子浓度为0.001 mol•L-1,废水排放速率10L•s-1,为了变成无游离氯的中性水,在废水排出管的A、B处,分别注入0.1 mol•L-1 NaOH溶液和0.2 mol•L-1 Na2SO3溶液。
![]()
![]()
![]()
(1)在A、B处各应注入何种溶液?为什么?
![]() (2)两种液体的流量应控制多大?
(2)两种液体的流量应控制多大?
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022
![]()
![]()
![]()
(1)在A、B处各应注入何种溶液?为什么?
![]() (2)两种液体的流量应控制多大?
(2)两种液体的流量应控制多大?
查看答案和解析>>
科目:高中化学 来源:高中化学习题 题型:038
某工业废水里含游离氯0.014mol/L,![]() 为0.0010mol/L,废水排放速度10L/s,为了使该废水变为无游离氯的中性废水,在废水排出管的A、B处,分别注入0.10mol/L的
为0.0010mol/L,废水排放速度10L/s,为了使该废水变为无游离氯的中性废水,在废水排出管的A、B处,分别注入0.10mol/L的![]() 溶液和0.20mol/L
溶液和0.20mol/L![]() 溶液
溶液

(1)在A、B处各应注入何种溶液?为什么?
(2)两种溶液的流量应控制多大?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com