
【题目】下列有关混合物、纯净物、电解质、非电解质的正确组合为( )
纯净物 | 混合物 | 电解质 | 非电解质 | |
A. | 纯盐酸 | 水煤气 | 硫酸 | 干冰 |
B. | 蒸馏水 | 蔗糖溶液 | 氧化铝 | 二氧化硫 |
C. | 胆矾 | 氢氧化铁胶体 | 铁 | 碳酸钙 |
D. | 水银 | 澄清石灰水 | 氯化铜 | 碳酸钠 |
A.A
B.B
C.C
D.D
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的污染。下列做法不符合绿色化学理念的是( )
A.研制水溶剂涂料替代有机溶剂涂料
B.用可降解塑料生产包装盒或快餐盒
C.用反应:![]() 制备硫酸铜
制备硫酸铜
D.用反应:![]() 制备环氧乙烷
制备环氧乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于合金的叙述不正确的是
A.合金的熔点一般比它的各成分金属的熔点低
B.合金的硬度一般比它的各成分金属的硬度大
C.合金的性质一般是各成分金属性质的总和
D.合金在工业上的用途比纯金属更广
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】11.2g Fe加入一定量的HNO3充分反应后,生成Fe2+、Fe3+的物质的量之比为1:4,将生成的气体NXOY与一定量的O2混合后通入水中,反应后无气体剩余(NXOY+O2+H2O-HNO3 ),则通入的氧气的物质的量是
A. 0.12mol B. 0.14mol C. 0.2mol D. 0.13mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是新一代饮用水的消毒剂,我国许多自来水厂采用ClO2代替Cl2来进行自来水消毒。请回答下列有关问题:
(1)ClO2读作____________,它属于________(选填“单质”“氧化物”或“混合物”)。
(2)ClO2中氯元素的化合价为__________。
(3)我国最近成功研制出制取ClO2的新方法,其反应的微观过程如图所示:

该反应的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硝酸锶[Sr(NO3)2]可用于制造信号灯、光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:
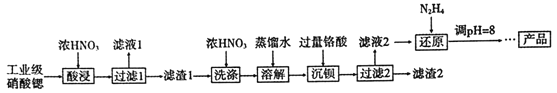
已知: ①“滤液1”的主要溶质是Ca(NO3)2;“滤渣1”的成分为Ba(NO3)2、Sr(NO3)2;“滤渣2”的主要成分为BaCrO4
②铬酸(H2CrO4)为弱酸
(1)“酸浸”不能采用高温的原因是_______。
(2)相对于水洗,用浓HNO3洗涤的优点是_______。
(3)“滤液2”中过量的H2CrO4被N2H4还原为Cr3+,同时放出无污染的气体,写出反应的离子方程式____。
(4)在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+(aq) +3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=1.0×10-32,当c(Cr3+)降至1.0×10-5mol/L,认为Cr3+已经完全沉淀。现将还原后溶液的pH值调至4,此时Cr3+是否沉淀完全? ___( 列式计算)。
Cr3+(aq) +3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=1.0×10-32,当c(Cr3+)降至1.0×10-5mol/L,认为Cr3+已经完全沉淀。现将还原后溶液的pH值调至4,此时Cr3+是否沉淀完全? ___( 列式计算)。
(5)已知Cr(OH)3类似Al(OH)3,还原后溶液的pH不能大于8的原因是_______(结合离子方程式说明理由)。
(6)为了测定“滤渣2”中BaCrO4的含量,进行以下实验:
m g“滤渣2”![]() 溶液
溶液![]() 滴定终点时消耗VmLNa2S2O3溶液(已知:I2+2S2O32-=2I-+S4O62-)
滴定终点时消耗VmLNa2S2O3溶液(已知:I2+2S2O32-=2I-+S4O62-)
①若加入的HI溶液过量太多,测定结果会_____(填“偏低”、“偏高”或“无影响”)。
②“滤渣2”中BaCrO4(摩尔质量为Mg/mol)的质量分数为_____(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. MnO2+ 4HCl(浓)![]() MnCl2 +Cl2↑ + 2H2O中,氧化剂和还原剂物质的量之比为1∶4
MnCl2 +Cl2↑ + 2H2O中,氧化剂和还原剂物质的量之比为1∶4
B. 2H2S+ SO2=3S+2H2O中,氧化产物和还原产物物质的量之比为1∶1
C. 3S+ 6KOH=2K2S+ K2SO3+3H2O中,被氧化和被还原的硫元素物质的量之比为2∶1
D. Al2O3+N2+3C![]() 2AlN+3CO中,氧化剂和还原剂物质的量之比为1∶3
2AlN+3CO中,氧化剂和还原剂物质的量之比为1∶3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com