
| A. | 根据化学反应速率的大小可以知道化学反应进行的快慢 | |
| B. | 化学反应速率是指一定时间内任何一种反应物的量的减少或任何一种生成物的量的增加 | |
| C. | 化学反应速率为0.8mol/(L•s)是指1 s时某物质的浓度为0.8mol/L | |
| D. | 对于任何化学反应来说,反应速率越快,反应现象越明显 |
分析 A、化学反应速率是衡量化学反应进行快慢程度的物理量.
B、化学反应速率适用于溶液或气体.
C、化学反应速率表示单位时间内反应物浓度的减少或生成物浓度的增加.
D、反应速率与反应现象没有直接关系.
解答 解:A、化学反应速率是描述化学反应快慢的物理量,根据化学反应速率可以知道化学反应进行的快慢,故A正确;
B、化学反应速率适用于溶液或气体,不适用于固体或纯液体,故B错误;
C、化学反应速率为“0.8mol/(L•s)”表示的意思是:时间段为1s时,某物质的浓度增加或减少0.8mol/L,故C错误;
D、反应速率快的现象不一定明显,如NaOH与HCl的反应,反应速率慢的现象可能明显,如铁生锈,故D错误.
故选A.
点评 本题考查化学反应速率是对学生基础知识的考查,较简单,但选项D是学生解答中的易错点.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
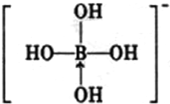 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,稀释到原体积的10倍后,溶液的pH=4 | |
| B. | 溶液中所有离子的浓度都减小 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 再加入10mLpH=11的NaOH溶液,混合液的pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色食品就是指颜色为绿色的食品 | B. | 白色污染是指白色的废弃物的污染 | ||
| C. | 食盐加碘是为了预防“大脖子”病 | D. | 有机食品是指含有有机物的食品 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com