
【题目】下列四种溶液中,室温下由水电离生成的H+浓度之比(①∶②∶③∶④)是
① 1 mol·L-1的盐酸 ② 0.1 mol·L-1的盐酸
③ 0.01 mol·L-1的NaOH溶液 ④ 0.001 mol·L-1的NaOH溶液
A. 1∶10∶100∶1 000B. 0∶1∶12∶11C. 14∶13∶12∶11D. 14∶13∶2∶3
【答案】A
【解析】
酸溶液中计算水电离出H+浓度,根据水的离子积,先求出溶液中c(OH-),因为水电离出H+浓度等于水电离出OH-浓度,同理碱溶液中计算水电离出OH-浓度,计算溶液中H+浓度;
①1mol·L-1的盐酸中c(H+)=1mol·L-1,溶液中c(OH-)=Kw/c(H+)=10-14/1mol·L-1=10-14mol·L-1,H2O![]() H++OH-,水电离出c(H+)等于水电离出c(OH-),即1mol·L-1盐酸溶液中水电离出c(H+)=10-14mol·L-1;②根据①,0.1mol·L-1的盐酸中水电离出c(H+)=10-13mol·L-1;③0.01mol·L-1的NaOH溶液中c(OH-)=0.01mol·L-1,溶液中c(H+)=10-12mol·L-1,该H+由水电离产生,即水电离出c(H+)=10-12mol·L-1;④同理③,0.001mol·L-1的NaOH溶液中水电离出c(H+)=10-11mol·L-1;因此H+浓度之比为10-14:10-13:10-12:10-11=1:10:100:1000,故A正确。
H++OH-,水电离出c(H+)等于水电离出c(OH-),即1mol·L-1盐酸溶液中水电离出c(H+)=10-14mol·L-1;②根据①,0.1mol·L-1的盐酸中水电离出c(H+)=10-13mol·L-1;③0.01mol·L-1的NaOH溶液中c(OH-)=0.01mol·L-1,溶液中c(H+)=10-12mol·L-1,该H+由水电离产生,即水电离出c(H+)=10-12mol·L-1;④同理③,0.001mol·L-1的NaOH溶液中水电离出c(H+)=10-11mol·L-1;因此H+浓度之比为10-14:10-13:10-12:10-11=1:10:100:1000,故A正确。


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】氨水、胆矾都是中学实验室中常见的化学试剂,它们在工农业生产上也都有广泛应用。某研究性学习小组为测定氨水的浓度,并用氨水作为提纯胆矾时的试剂,根据所查阅资料设计实验如下:
查阅资料:
①甲基橙的变色范围:pH<3.1红色,pH=3.1~4.4橙色, pH>4.4黄色
②酚酞的变色范围:pH<8.2无色 ,pH=8.2~10.0粉红色,pH>10.0红色
③已知:Fe3+、Fe2+、Cu2+转化为氢氧化物时相应的pH如下表:
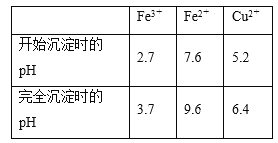
实验一 标定氨水的浓度
取25.00mL约为0.10 mol·L-1氨水于锥形瓶中,用0.1000 mol·L-1盐酸进行滴定,实验所得数据如下表所示:
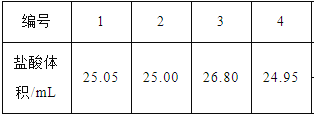
(1)滴定产物水解的离子方程式为____________________________________,由此可推知选择的滴定指示剂应为__________________。(填“甲基橙”或“酚酞”)
(2)该氨水的准确浓度为____________________mol·L-1。(精确到小数点后四位)
(3)编号3中溶液的离子浓度由大到小的顺序为__________________________________。
实验二 提纯胆矾晶体
某学习小组同学拟从含FeSO4、Fe2(SO4)3杂质的CuSO4溶液中提纯胆矾,其主要实验步骤如下:
第一步 往混合液中加入3% H2O2溶液充分反应后,再加入稀氨水调节溶液pH,过滤。
第二步 往滤液中加入稀硫酸调节溶液pH至1~2,提纯胆矾。
(4)加入3% H2O2溶液的作用是___________________________。
(5)加稀氨水调节pH应调至范围___________________________。
(6)下列物质可用来替代稀氨水的是___________________________。(填序号)
A.NaOH B.Cu(OH)2 C.CuO D.NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列金属的冶炼方法中,属于热还原法的是( )
A. 2Ag2O![]() 4Ag+O2↑B. Fe+CuSO4===FeSO4+Cu
4Ag+O2↑B. Fe+CuSO4===FeSO4+Cu
C. Fe2O3+3CO![]() 2Fe+3CO2D. MgCl2(熔融)
2Fe+3CO2D. MgCl2(熔融) ![]() Mg+Cl2↑
Mg+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B和C为常见气体,A是所有气体中密度最小的气体;B是黄绿色气体;C能使湿润的红色石蕊试纸变蓝。D是目前用量最大,用途最广的金属。请回答下列问题:
(1)A是________(填化学式)
(2)实验室制取C时,常用________(填“向下”或“向上”)排空气法收集;
(3)B与D的单质在点燃条件下反应的化学方程式为______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mX(g)![]() nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示,下列说法错误的是( )
nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示,下列说法错误的是( )
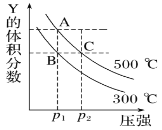
A. 该反应的ΔH>0
B. m<n+p
C. B、C两点化学平衡常数:KB>KC
D. A、C两点的反应速率v(A)<v(C)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:
CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1
COS(g)+H2(g) K=0.1
反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是
A. 升高温度,H2S浓度增加,表明该反应是吸热反应
B. 通入CO后,正反应速率逐渐增大
C. 反应前H2S物质的量为7mol
D. CO的平衡转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a. CH4(g)+H2O(g)CO(g)+3H2(g) H1=+216.4kJ/mol
b. CO(g)+H2O(g)CO2(g)+H2(g) H2=-41.2kJ/mol
则反应CH4(g)+2H2O(g)CO2(g)+4H2(g) H=___。
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。
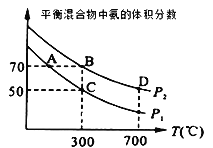
①恒压时,反应一定达到平衡状态的标志是___(填序号)
A. N2和H2的转化率相等 B. 反应体系密度保持不变
C. ![]() 保持不变 D.
保持不变 D. ![]() =2
=2
②P1___P2 (填“>”“=”或“<”,下同);反应的平衡常数:B点___D点。
③C点H2的转化率为__;
Ⅱ.用间接电化学法去除烟气中NO的原理如图所示。
(3)已知阴极室溶液呈酸性,则阴极的电极反应式为____。反应过程中通过质子膜的H+为2mol时,吸收塔中生成的气体在标准状况下的体积为____L。
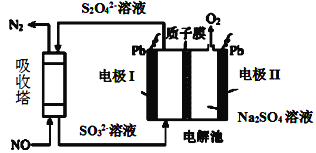
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将定量的Na2CO3和NaHCO3的混合物加热到不再放出气体时,收集到CO2aL,冷却后向残余物中加入足量盐酸又收集到CO2 2 aL (体积均在标准状况下测定)。则混合物中Na2CO3和NaHCO3的物质的量之比为( )
A. 1:1 B. 1:2 C. 1:3 D. 1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有OH-、AlO2-、SiO32-、CO32-、SO42-、K+、Na+、Fe3+、Mg2+、Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示.下列判断正确的是( )
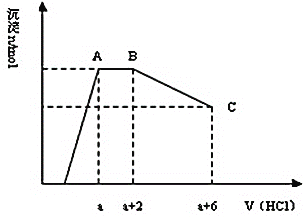
A.原溶液中一定含有Na2SO4
B.反应后形成的溶液溶质为NaCl
C.原溶液中含有CO32-与AlO2-的物质的量比为3:4
D.原溶液中一定含有的离子是OH-、AlO2-、SiO32-、CO32-、K+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com