
���� 1mol�������ΪC3H8O��Һ̬�л���A���������Ľ��������ã�������11.2L��������״��������A�����к���һ��-OH��A����ͭ������ʱ��������һ����ȣ�����������Ӧ����D��D�ܷ���������Ӧ����AΪCH3CH2CH2OH��DΪCH3CH2CHO��A��Ũ���Ṳ�ȣ���������ȥ1����ˮ����B����BΪCH3CH=CH2��Bͨ����ˮ�ܷ�����Ӧ����CΪCH3CHBrCH2Br���ݴ˽��
��� �⣺1mol�������ΪC3H8O��Һ̬�л���A���������Ľ��������ã�������11.2L��������״��������A�����к���һ��-OH��A����ͭ������ʱ��������һ����ȣ�����������Ӧ����D��D�ܷ���������Ӧ����AΪCH3CH2CH2OH��DΪCH3CH2CHO��A��Ũ���Ṳ�ȣ���������ȥ1����ˮ����B����BΪCH3CH=CH2��Bͨ����ˮ�ܷ�����Ӧ����CΪCH3CHBrCH2Br��
��A��D�ķ�Ӧ����ʽΪ��2CH3CH2CH2OH+O2$��_{��}^{Cu}$2CH3CH2CHO+2H2O��
��D����������Ӧ�ķ���ʽΪ��CH3CH2CHO+2Ag��NH3��2OH$\stackrel{��}{��}$CH3CH2COONH4+2Ag��+3NH3+H2O��
�ʴ�Ϊ��CH3CH2CH2OH��CH3CHBrCH2Br��2CH3CH2CH2OH+O2$��_{��}^{Cu}$2CH3CH2CHO+2H2O��
CH3CH2CHO+2Ag��NH3��2OH$\stackrel{��}{��}$CH3CH2COONH4+2Ag��+3NH3+H2O��
���� ���⿼���л����ƶϣ���Ҫѧ���������չ����ŵ�������ת�����ܹ���ȷ��д�����л���Ӧ����ʽ���ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
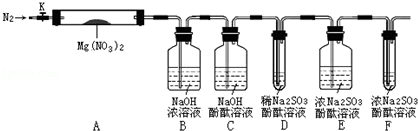
 ��������У�ͨ��һ��ʱ��N2��Ŀ���DZ���Էֽ����O2�ļ���������ţ�
��������У�ͨ��һ��ʱ��N2��Ŀ���DZ���Էֽ����O2�ļ���������ţ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����γ��ȶ�����̬�⻯�� | B�� | ��ԭ���������6������ | ||
| C�� | ������������ˮ������ǿ�� | D�� | X�ǽ���Ԫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.21 mol | B�� | 0.25 mol | C�� | 0.3 mol | D�� | 0.35mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
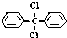 ���Ը÷��ӵ���������ȷ���ǣ�������
���Ը÷��ӵ���������ȷ���ǣ�������| A�� | �˷����д�����6�ֲ�ͬ��ѧ��������ԭ�� | |
| B�� | ����̼ԭ��һ������ͬһƽ���� | |
| C�� | �˷���������ˮ | |
| D�� | �˷����������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ʵ���� | C��HA��mol•L-1 | c��MOH��/mol•L-1 | �����Һ��pH |
| �� | pH=2 | pH=12 | pH��7 |
| �� | 0.1 | 0.1 | pH=a |
| �� | c1 | 0.2 | pH=7 |
| �� | 0.2 | 0.1 | pH��7 |
| A�� | a��7 | |
| B�� | ��������Һ��c��OH-��-c��HA��=10-amol/L | |
| C�� | c1��0.2 | |
| D�� | �ڶ�����Һ��c��M+����c��A-�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com