
科目:高中化学 来源: 题型:
| A、能使蓝色石蕊试纸变红色的溶液中:K+、Na+、CO32-、NO3- |
| B、水电离出的c(H+)=1×10-12mol/L的溶液中:Na+、Mg2+、Cl-、SO42- |
| C、能使碘化钾淀粉试纸变蓝的溶液中:Na+、NH4+、S2-、Br- |
| D、c(H+)=1×10-1mol/L的溶液中:Cu2+、Al3+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气与水反应:Cl2+H2O=2H++Cl-+ClO- |
| B、钠与水反应:2Na+2H2O=2Na++2OH-+H2↑ |
| C、Ba(OH)2溶液与稀硫酸反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| D、FeCl3溶液刻蚀铜制的印刷电路板:Cu+Fe3+=Cu2++Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
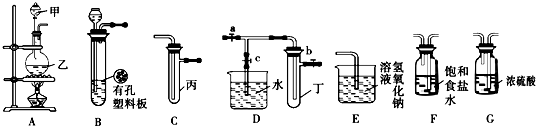
查看答案和解析>>
科目:高中化学 来源: 题型:
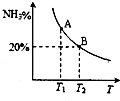 合成氨技术的发明使工业化人工固氮成为现实.
合成氨技术的发明使工业化人工固氮成为现实.| 温度/℃ CO2转化率%
|
100 | 150 | 200 | ||
| 1 | 19.6 | 27.1 | 36.6 | ||
| 1.5 | a | b | c | ||
| 2 | d | e | f |
查看答案和解析>>
科目:高中化学 来源: 题型:
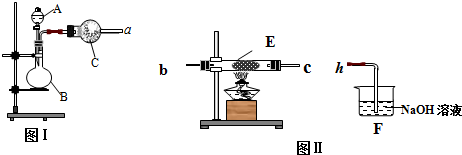
查看答案和解析>>
科目:高中化学 来源: 题型:
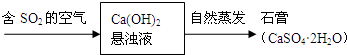

查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com