
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加KSCN溶液 | 溶液变红色 | 固体物质中有FeCl3 |
| 在酸性KMnO4溶液中加少量A溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含FeCl2 |
分析 (1)根据类比法,结合铁和硝酸反应的产物,产物可能为FeCl2、FeCl3或二者的混合物;
(2)铁离子和硫氰根离子反应生成血红色硫氰化铁,亚铁离子具有还原性能被酸性高锰酸钾氧化;
(3)在加热条件下,氯气和铁反应生成氯化铁;
(4)A为FeCl3溶液,
A.将FeCl3溶液滴入沸水中,并继续加热得到红褐色液体,该液体为氢氧化铁胶体,能产生丁达尔现象;
B.在FeCl3溶液中加入碘化钾淀粉溶液,铁离子能氧化碘离子生成碘单质,所以滴入淀粉碘化钾溶液中,可得到蓝色液体;
C.在FeCl3溶液中滴加NaOH浓溶液,出现氢氧化铁红褐色沉淀;
D.氯化铁溶液蒸干并灼烧得到水解错误氢氧化铁分解生成氧化铁,据此答题
(5)根据Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=4.0×10-38计算开始沉淀时c(OH-),再根据水的离子积计算溶液中c(H+),根据稀释定律计算需要盐酸的体积,氯化铁水解生成氢氧化铁和盐酸,加入盐酸会抑制氯化铁的水解.
解答 解:(1)根据类比法,结合铁和硝酸反应的产物,产物可能为FeCl2、FeCl3、FeCl3和FeCl2的混合物,
故答案为:FeCl3,FeCl3和FeCl2的混合物;
(2)铁离子和硫氰根离子反应生成血红色硫氰化铁,分别向A、B溶液中加KSCN溶液,溶液中含有氯化铁,铁离子和硫氰化钾反应反应而使溶液呈血红色,亚铁离子具有还原性,能被酸性高锰酸钾溶液氧化,如果向分别向KMnO4溶液中加入适量A、B溶液,KMnO4溶液颜色无明显变化,说明不含氯化亚铁,
故答案为:溶液变红色;FeCl2;
(3)在加热条件下,铁在氯气中反应生成氯化铁,反应方程式为:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3,
故答案为:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3;
(4)A为FeCl3溶液,
A.将FeCl3溶液滴入沸水中,并继续加热得到红褐色液体,该液体为氢氧化铁胶体,能产生丁达尔现象,故A正确;
B.在FeCl3溶液中加入碘化钾淀粉溶液,铁离子能氧化碘离子生成碘单质,所以滴入淀粉碘化钾溶液中,可得到蓝色液体,故B正确;
C.在FeCl3溶液中滴加NaOH浓溶液,出现氢氧化铁红褐色沉淀,故C正确;
D.将A溶液加热蒸干并灼烧,氯化铁水解被促进生成氢氧化铁,灼烧氢氧化铁分解生成氧化铁和水,不能得到FeCl3固体,故D错误;
故答案为:D;
(5)溶液中c(Fe3+)=5mol/L,根据Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=4.0×10-38,可知开始沉淀时c(OH-)=2×10-13mol/L,则溶液中c(H+)=$\frac{1{0}^{-14}}{2×1{0}^{-13}}$mol/L=0.05mol/L,根据稀释定律,需要盐酸的体积为$\frac{0.05mol/L×100ml}{2mol/L}$=2.5mL,加入盐酸的目的是抑制氯化铁水解,
故答案为:2.5;抑制氯化铁水解.
点评 本题考查了实验探究物质的组成、电解原理的应用等,明确物质的性质是解本题关键,知道氧化性强弱的判断方法,亚铁离子和铁离子的检验是常考查点,题目难度中等.


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| A. | S$→_{点燃}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | Al2O3$→_{△}^{NaOH}$NaAlO2(ap)$\stackrel{CO_{2}}{→}$Al(OH)3(s) | |
| C. | Fe$→_{高温}^{H_{2}O}$Fe2O3$\stackrel{盐酸}{→}$FeCl3(ap) | |
| D. | Cu$→_{H_{2}SO_{4},△}^{O_{2}}$CuSO4(ap)$→_{△}^{过量NaOH(ap),葡萄糖}$CuO(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 制备Fe(OH)3胶体 | 将NaOH浓溶液滴加到热饱和FeCl3溶液中 |
| B | 由MgCl2溶液制备无水MgCl2 | 将MgCl2溶液加热蒸干 |
| C | “侯氏制碱法”过程中制取NaHCO3 | 将过量CO2通入到NH3和食盐的饱和溶液中 |
| D | 证明CH3COOH是弱酸 | 将CH3COOH与Na2CO3溶液反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
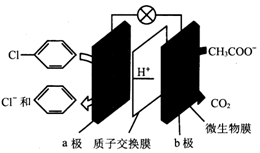
| A. | 该装置能将化学能转化为电能 | |
| B. | a极发生还原反应 | |
| C. | b极电极反应为CH3COO-+2H2O-8e-═2CO2↑+7H+ | |
| D. | 每除去1mol氯苯,电路中转移1mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 土壤胶体带负电荷,有利于铵态氮肥的吸收 | |
| B. | “辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 | |
| C. | SiCl4在战争中常用作烟雾弹,是因为它水解时生成白色烟雾 | |
| D. | “雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮氧化物无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用过滤的方法除去食盐中的泥沙 | |
| B. | 用蒸馏的方法将自来水制成蒸馏水 | |
| C. | 用酒精萃取溴水中的溴 | |
| D. | 用蒸发浓缩、降温结晶、过滤的方法从硝酸钾和氯化钠的混合溶液中获得硝酸钾晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com