
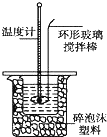
 某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
分析 Ⅰ.(1)根据公式m=nM=cVM来计算氢氧化钠的质量,但是没有245mL的容量瓶;
Ⅱ.(1)①先判断温度差的有效性,然后求出温度差平均值;
②先根据Q=m•c•△T计算反应放出的热量,然后根据△H=-$\frac{Q}{n}$kJ/mol计算出反应热,然后依据中和热是强酸和强碱的稀溶液完全反应生成1mol水放出的热量,标注物质聚集状态和对应焓变写出热化学方程式;
③a.装置保温、隔热效果差,测得的热量偏小;
b.所用硫酸为浓硫酸,浓硫酸稀释放热,测得的热量偏大;
c.铜质搅拌棒导热,热量散失,测得的热量偏小;
d.倒完NaOH溶液后,发现装NaOH烧杯内有极少量残留液,则参加反应的NaOH偏小,测得的热量偏小.
解答 解:Ⅰ.(1)需要称量NaOH固体m=nM=cVM=0.5mol/L×0.25L×40g/mol=5.0g,故答案为:5.0;
Ⅱ.(1)①4次温度差分别为:4.0℃,6.1℃,3.9℃,4.1℃,第2数据舍去,其他三次温度差平均值=$\frac{4.0℃+3.9℃+4.1℃}{3}$=4.0℃,
故答案为:4.0;
②50mL0.50mol/L氢氧化钠与30mL0.50mol/L硫酸溶液进行中和反应生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:80ml×1g/ml=80g,温度变化的值为△T=4℃,则生成0.025mol水放出的热量为Q=m•c•△T=80g×4.18J/(g•℃)×4.0℃=1337.6J,即1.3376KJ,所以实验测得的中和热△H=-$\frac{1.3376KJ}{0.025mol}$=-53.5 kJ/mol,即稀强酸、稀强碱反应生成1mol液态水时放出53.5kJ热量,稀硫酸和氢氧化钠稀溶液反应的热化学方程式为:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-53.5kJ/mol,
故答案为:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-53.5kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热数值偏小,故a正确;
b.所用硫酸为浓硫酸,浓硫酸稀释放热,测得的热量偏大,中和热数值偏大,故b错误;
c.铜质搅拌棒导热,热量散失,测得的热量偏小,中和热数值偏小,故c正确;
d.倒完NaOH溶液后,发现装NaOH烧杯内有极少量残留液,则参加反应的NaOH偏小,测得的热量偏小,中和热数值偏小,故d正确.
故答案为:acd.
点评 本题主要考查热化学方程式以及反应热的计算,题目难度不大,注意理解中和热的概念、把握热化学方程式的书写方法,以及测定反应热的误差等问题.


科目:高中化学 来源: 题型:多选题
| A. | 每个白藜芦醇分子中含有6个氢分子 | |
| B. | 白藜芦醇由碳、氢、氧三种元素组成 | |
| C. | 白藜芦醇的相对分子质量为228 | |
| D. | 白藜芦醇中碳、氢、氧三种元素的质量比为14:12:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{3}$mol | B. | $\frac{4}{3}$mol | C. | 1mol | D. | 2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
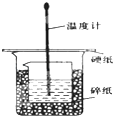 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如 图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如 图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差 (t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 学习小组设计了如图实验(部分装置),将氯气依次通过下列装置以验证氯气的性质:
学习小组设计了如图实验(部分装置),将氯气依次通过下列装置以验证氯气的性质:| 实验步骤 | 预期现象和结论 |
步骤1:取适量洗气瓶B中溶液于试管A中,滴加滴加过量2mol/LHCl(1分)和1mol/LBaCl2溶液,振荡. | 若产生的白色沉淀,则洗气瓶B溶液中存在SO42-. |
步骤2:另取适量洗气瓶B中溶液于试管B中,滴加滴加入过量lmol/LBa(NO3)2溶液,振荡,静置. | 产生白色沉淀. |
步骤3:取步骤2后试管B中的上层清液于试管C中, 滴加0.1mol/LAgNO3溶液和过量的2mol/LHNO3,振荡. | 若产生白色沉淀,则洗气瓶B溶液中存在氯离子. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn为正极,碳为负极 | |
| B. | 负极反应为2NH4++2e-═2NH3↑+H2↑ | |
| C. | 工作时电子由碳极经外电路流向锌极 | |
| D. | 长时间连续使用时,内装的糊状物可能流出腐蚀电器 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 6 | C. | 8 | D. | 10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com